Тромбоэмболия лёгочной артерии
Тромбоэмболи́я лёгочной арте́рии (ТЭЛА) — закупорка лёгочной артерии или её ветвей тромбами, которые образуются чаще в крупных венах нижних конечностей или таза (эмболия). В зарубежной литературе распространено более широкое понятие лёгочная эмболия, которое также включает в себя редкие воздушные, жировые эмболии, эмболии амниотической жидкостью, инородными телами, опухолевыми клетками.
Что важно знать
Эпидемиология
ТЭЛА — относительно распространённая сердечно-сосудистая патология (примерно 1 случай на тысячу населения в год)[2]. В США ТЭЛА наблюдают примерно у 650 000 человек, которая приводит к 350 000 смертям в год[3]. ТЭЛА чаще возникает у пожилых (В США в год венозная тромбоэмболия возникает первый раз примерно у 100 человек из 100 000 и экспоненциально растёт от менее 5 случаев на 100 000 человек у детей до 15 лет до 500 случаев на 100 000 человек в возрасте 80 лет)[4]. Данные о связи пола с ТЭЛА разнятся, однако анализ национальной базы данных США выявил, что у мужчин смертность на 20—30% выше, чем у женщин[5]. Заболеваемость венозной тромбоэмболией среди пожилых выше у мужчин, но у пациентов моложе 55 лет — выше у женщин[6].
Причины и факторы риска
В основе заболевания лежит тромбообразование, которому способствуют три фактора (триада Вирхова): нарушение кровотока (стаз крови), повреждение эндотелия сосудистой стенки, гиперкоагуляция (а так же угнетение фибринолиза).
Нарушение кровотока обусловлено варикозным расширением вен, сдавлением сосудов извне (опухолью, кистой, костными отломками, увеличенной маткой), разрушением клапанов вен после перенесённого флеботромбоза, а также иммобилизация, которая нарушает функцию мышечно-венозной помпы нижних конечностей. Полицитемия, эритроцитоз, дегидратация, диспротеинемия, повышенное содержание фибриногена повышают вязкость крови, что замедляет кровоток.
При повреждении эндотелия обнажается субэндотелиальная зона, что запускает каскад реакций свёртывания крови. Причины этого — прямое повреждение стенки сосуда при установке внутрисосудистых катетеров, фильтров, стентов, протезировании вен, травме, операции. Также к повреждению эндотелия приводят гипоксия, вирусы, эндотоксины. При системной воспалительной реакции активируются лейкоциты, которые прикрепляясь к эндотелию повреждают его.
Источником тромбов при ТЭЛА чаще служат вены нижних конечностей (тромбоз вен нижних конечностей), намного реже — вены верхних конечностей и правые отделы сердца. Вероятность венозного тромбоза повышается у беременных женщин, у женщин, длительное время принимавших пероральные контрацептивы, у больных тромбофилией.
Согласно рекомендациям Европейского общества кардиологов 2008 года больных стратифицируют на группы высокого и невысокого риска. Также последнюю подразделяют на подгруппы умеренного и низкого риска. Высокий риск — риск ранней смерти (в стационаре или в течение 30 дней после ТЭЛА) более 15%, умеренный — не более 15%, низкий — менее 1%[7]. Для его определения учитывают три группы маркеров — клинические маркеры, маркеры дисфункции правого желудочка и маркеры повреждения миокарда.
Также вероятность ТЭЛА оценивают по шкале Уэллса (Wells score, 2001)[8].
| Показатель | Баллы |
|---|---|
| Клинические симптомы тромбоза глубоких вен нижних конечностей (объективная припухлость нижней конечности, причиняющая боль пальпация) | 3 |
| ТЭЛА более вероятна, чем другие патологии | 3 |
| Тахикардия >100 ударов/мин | 1,5 |
| Иммобилизация или хирургическое вмешательство на протяжении последних 3 дней | 1,5 |
| Тромбоз глубоких вен нижних конечностей или ТЭЛА в анамнезе | 1,5 |
| Кровохарканье | 1 |
| Онкологическая патология в настоящее время или давностью до 6 мес | 1 |
Если сумма баллов <2 — вероятность ТЭЛА низкая; 2—6 баллов — умеренная; >6 баллов — высокая.
Нередко используют Женевскую шкалу (2006)[9].
| Показатель | Баллы |
|---|---|
| Возраст >65 лет | 1 |
| Тромбоз глубоких вен нижних конечностей или ТЭЛА в анамнезе | 3 |
| Хирургическое вмешательство или перелом на протяжении последнего месяца | 2 |
| Онкологическая патология | 2 |
| Подозрение на тромбоз глубоких вен нижних конечностей (боль в одной конечности) | 3 |
| Кровохарканье | 2 |
| Тахикардия 75—94 уд/мин | 3 |
| Тахикардия ≥ 95 уд/мин | 5 |
| Боль при пальпации вены + отёк одной конечности | 4 |
Если сумма баллов <3 — вероятность ТЭЛА низкая; 4—10 баллов — умеренная; ≥ 11 баллов — высокая.
Патогенез
Эмболизацию вызывают свободно расположенные в просвете вены тромбы, прикреплённые к её стенке лишь в зоне его основания (флотирующие тромбы). Оторвавшийся тромб с током крови через правые отделы сердца попадает в лёгочную артерию, обтурируя её просвет. Последствия этого зависят от размеров, количества эмболов, реакции лёгких и активности тромболитической системы организма.
При эмболах небольших размеров симптомы отсутствуют. Крупные эмболы ухудшают перфузию сегментов или даже целых долей лёгкого, что приводит к нарушению газообмена и развитию гипоксии. В ответ на это рефлекторно сужается просвет сосудов малого круга кровообращения, повышается давление в лёгочных артериях. Увеличивается нагрузка на правый желудочек из-за высокого лёгочного сосудистого сопротивления, вызванного обструкцией и вазоконстрикцией. Тромбоэмболия мелких ветвей лёгочной артерии не сопровождается расстройствами гемодинамики и в 10% случаев развивается инфаркт лёгкого и вторичная инфарктная пневмония.
Классификация
Клинически ТЭЛА классифицируют на следующие типы:
- массивная — поражено более 50 % объёма сосудистого русла лёгких (эмболия лёгочного ствола и/или главных лёгочных артерий) и заболевание проявляется шоком и/или системной гипотензией;
- субмассивная — поражено 30 — 50 % объёма сосудистого русла лёгких (эмболия нескольких долевых или многих сегментарных лёгочных артерий) и проявляется симптомами правожелудочковой недостаточности;
- немассивная — поражено менее 30 % объёма сосудистого русла лёгких (эмболия мелких дистальных лёгочных артерий), проявления отсутствуют либо минимальны (инфаркт лёгкого).
Клиническая картина
Эмболия мелких ветвей лёгочных артерий может протекать бессимптомно или иметь неспецифичные симптомы (незначительное повышение температуры тела, кашель).
Массивная ТЭЛА проявляется острой правожелудочковой недостаточностью с развитием шока и системной гипотензии (снижение артериального давления <90 мм рт.ст. или его падение на ≥40 мм рт.ст., что не связано с аритмией, гиповолемией или сепсисом). Могут возникать одышка, тахикардия, обморок. При субмассивной ТЭЛА артериальная гипотензия отсутствует, а давление в малом круге кровообращения повышается умеренно. При этом обнаруживают признаки дисфункции правого желудочка сердца и/или повреждения миокарда, что свидетельствует о повышенном давлении в лёгочной артерии. При немассивной ТЭЛА симптомы отсутствуют и через несколько дней возникает инфаркт лёгкого, который проявляется болью в грудной клетке при дыхании (за счёт раздражения плевры), лихорадкой, кашлем и, иногда, кровохарканьем и выявляется рентгенологически (типичные треугольные тени).
При аускультации сердца обнаруживают усиление и акцент II тона над трёхстворчатым клапаном и лёгочной артерией, систолический шум в этих точках. Возможны расщепление II тона, ритм галопа, что считают плохим прогностическим признаком. В области инфаркта лёгкого выслушивают ослабление дыхания, влажные хрипы и шум трения плевры.
Диагностика
Диагностика трудна, так как симптомы ТЭЛА неспецифичны, а диагностические тесты несовершенны. Стандартные методы обследования (обычные лабораторные тесты, электрокардиография (ЭКГ), рентгенография органов грудной клетки) полезны только для исключения другой патологии (например, пневмонии, пневмоторакса, переломов рёбер, инфаркта миокарда, отёка лёгких). К чувствительным и специфичным методам диагностики ТЭЛА относят определение d-димера, эхокардиография, компьютерная томография (КТ), вентиляционно-перфузионная сцинтиграфия, ангиография сосудов лёгких, а также методы диагностики тромбоза глубоких вен нижних конечностей (ультрасонография, КТ-венография).[10]
D-димер — продукт распада фибрина; его повышенный уровень предполагает недавнее тромбообразование. Определение уровня d-димеров — высокочувствительный (более 90 %), но не специфичный метод диагностики ТЭЛА. Это означает, что повышение уровня d-димеров происходит при большом количестве других патологических состояний (например, инфекция, воспалительные процессы, некроз, расслоение аорты). Однако нормальный уровень d-димеров (<500 мкг/л) позволяет исключить ТЭЛА у пациентов с низкой и средней вероятностью[11].
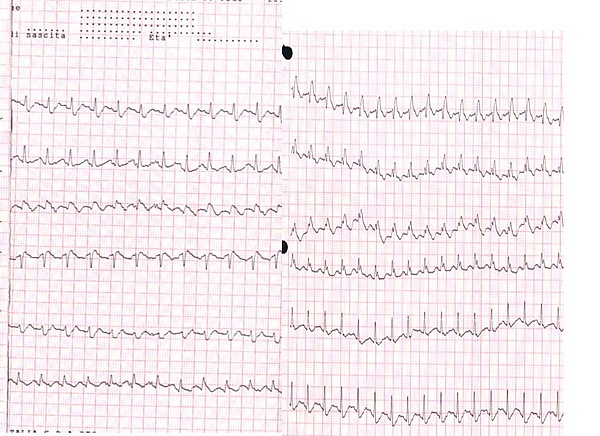
Признаки ТЭЛА на электрокардиограмме неспецифичны и у большинства больных отсутствуют[12]. Часто выявляют синусовую тахикардию, высокий и заострённый зубец P (P-pulmonale, признак перегрузки правого предсердия)[13]. Примерно у 20 % пациентов могут обнаруживаться признаки острого лёгочного сердца (перегрузки правого желудочка): отклонение электрической оси сердца вправо; синдром SIQIIITIII (синдром МакГинна-Уайта[14]) — глубокий зубец S в I отведении, выраженный зубец Q и отрицательный зубец T в III отведении; новая блокада правой ножки пучка Гиса; глубокие зубцы S в V5-6 в сочетании с отрицательными зубцами T в V1-4[15]. Однако острое лёгочное сердце может возникать и при других острых патологиях дыхательной системы (массивная пневмония, тяжёлый приступ бронхиальной астмы)[16].
При рентгенографии органов грудной клетки обнаруживают признаки лёгочной гипертензии тромбоэмболического происхождения: расширение правых отделов сердца и корней лёгкого, признак Палла (расширение правой нисходящей лёгочной артерии), симптом Вестермарка (локальное обеднение сосудистого рисунка лёгкого), дисковидные ателектазы. При инфаркте лёгкого — треугольник Хамптона (уплотнение конусообразной формы с вершиной, обращённой к воротам лёгких), плевральный выпот на стороне поражения.[12]
С помощью эхокардиографии при ТЭЛА можно выявить нарушение функции правого желудочка (его расширение и гипокинез, выбухание межжелудочковой перегородки в сторону левого желудочка), признаки лёгочной гипертензии, трикуспидальную регургитацию. Иногда удаётся обнаружить тромбы в полости сердца (для этого информативнее чреспищеводная ЭхоКГ)[17]. Также с помощью данного метода исключают другую патологию сердца, могут выявить открытое овальное окно, которое может влиять на выраженность гемодинамических расстройств и быть причиной парадоксальной эмболии артерий большого круга кровообращения[10].
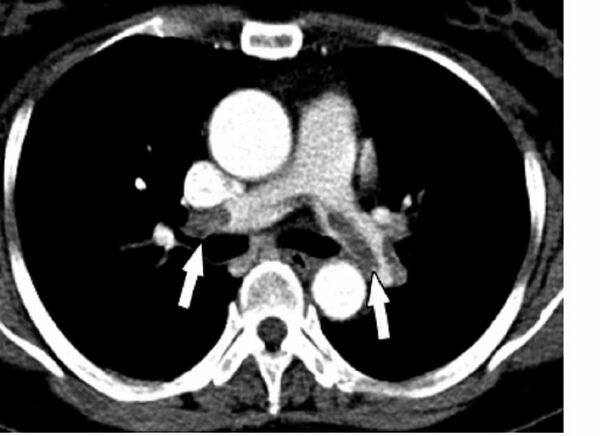
КТ-ангиопульмонография позволяет обнаружить тромбы в лёгочной артерии. При данном методе датчик вращается вокруг больного, которому предварительно вводится внутривенно контрастный препарат. В результате создаётся объёмная картина лёгких. Однако пациент должен суметь задержать дыхание во время процедуры (несколько секунд). Метод менее инвазивен и более безопасен, чем ангиография[10]. По мнению экспертов Европейского общества кардиологов у больных высокого риска достаточно однодетекторной КТ для подтверждения или исключения ТЭЛА. У больных невысокого риска рекомендуют мультидетекторную КТ, так как она позволяет более чётко выявить тромбы в ветвях лёгочной артерии[18].
Ультразвуковое исследование (УЗИ) периферических вен позволяет выявить тромбы в венах нижних конечностей. В большинстве случаев именно они служат источником тромбоэмболий. Для этого применяют две методики. Первая — компрессионное УЗИ; при этом в B-режиме получают поперечный сечение просвета артерий и вен. Затем УЗ-датчиком надавливают на кожу в проекции сосудов. При наличии тромба в вене, её просвет не уменьшается (сдавление не происходит). Другая методика — допплеровское УЗИ; при этом с помощью эффекта Допплера определяют скорость кровотока в сосудах. Снижение скорости кровотока в венах — возможный признак закупорки их тромбом. Комбинацию компрессионного и допплеровского УЗИ называют дуплексной ультрасонографией.
Вентиляционно-перфузионная сцинтиграфия позволяет выявить участки лёгкого, которые вентилируются, но не кровоснабжаются (в результате обструкции тромбом). Нормальная сцинтиграмма лёгких позволяет с точностью до 90 % исключить ТЭЛА. Однако дефицит перфузии может встречаться при множестве других патологий лёгких. Обычно данный метод применяют при противопоказаниях к КТ.
Ангиография сосудов лёгких — самый точный метод диагностики ТЭЛА, но в то же время инвазивный и не имеет преимуществ перед КТ. Критериями достоверного диагноза считают внезапный обрыв ветви лёгочной артерии и контуры тромба, критериями вероятного диагноза — резкое сужение ветви лёгочной артерии и медленное вымывание контраста.
Лечение
Лечение больных с ТЭЛА должно осуществляться в отделениях реанимации и интенсивной терапии.
При остановке сердца выполняют сердечно-лёгочную реанимацию. В случае возникновения гипоксии у пациента с ТЭЛА проводят оксигенотерапию (маски, носовые катетеры); реже требуется искусственная вентиляция лёгких. Для устранения гипотензии внутривенно вводят солевые растворы или вазопрессоры (адреналин, добутамин, допамин)[7].
Своевременная антикоагулянтная терапия снижает риск смерти и рецидивов тромбоэмболий, поэтому её рекомендуют начинать не только при подтверждённом диагнозе, но ещё в процессе диагностики при высокой вероятности ТЭЛА. Для этого применяют нефракционированный гепарин (внутривенно), низкомолекулярный гепарин: эноксапарин, далтепарин (подкожно) или фондапаринукс (подкожно).
Дозировку нефракционированного гепарина подбирают, учитывая массу пациента и активированное частичное тромбопластиновое время (АЧТВ)[19]. Для этого готовят раствор гепарина натрия — 20 000 МЕ/кг на 500 мл физиологического раствора. Вначале вводят внутривенно струйно 80 МЕ/кг, а затем проводят инфузию со скоростью 18 МЕ/кг/ч. Через 6 часов после струйного введения проверяют АЧТВ и корректирую скорость введения гепарина как указано в таблице. АЧТВ определяют через 3 часа после каждого изменения скорости; при достижении желаемого уровня (46—70 с, в 1,5—2,5 раза выше контроля) этот показатель контролируют ежедневно.
| АЧТВ, с | Изменение дозировки |
|---|---|
| <35 | Увеличить на 4 МЕ/кг/ч |
| 35—45 | Увеличить на 2 МЕ/кг/ч |
| 46—70 | Не изменять |
| 71—90 | Уменьшить на 2 МЕ/кг/ч |
| >90 | Прекратить введение на 1 ч, затем уменьшить на 3 МЕ/кг/ч |
В большинстве случаев применяют низкомолекулярные гепарины, так как они эффективнее, безопаснее и удобнее в применении, чем нефракционированный[20]. Однако с осторожностью их следует назначать при дисфункции почек (уменьшение клиренса креатинина <30 мл/мин) и при высоком риске геморрагических осложнений (длительность действия нефракционированного гепарина более короткая и поэтому его можно быстрее отменить в случае развития кровотечения). Из низкомолекулярных гепаринов рекомендованы: эноксапарин (1 мг/кг каждые 12 ч или 1,5 мг/кг 1 раз в сутки), тинзапарин (175 МЕ/кг 1 раз в сутки). У больных с онкологическими заболеваниями можно использовать дальтепарин (200 МЕ/кг 1 раз в сутки)[7].
Для антикоагуляции возможно применение фондапаринукса — селективного ингибитора фактора Xa. Его назначают подкожно 1 раз в сутки 5 мг при массе тела <50 кг, 7,5 мг — при 50—100 кг и 10 мг — если >100 кг. Он высокоэффективен при ТЭЛА и не вызывает тромбоцитопению, в отличие от гепарина. Однако фондапаринукс противопоказан при тяжёлой почечной недостаточности (клиренс креатинина <20 мл/мин)[7].
Также желательно уже в первый день введения антикоагулянтов прямого действия (гепарины или фондапаринукс) назначить варфарин. При достижении уровня международного нормализованного отношения (МНО) 2—3 и удержании его на таком уровне не менее 2 суток прямые антикоагулянты отменяют (но не ранее, чем через 5 суток от начала их применения). Начальная доза варфарина — 5 или 7,5 мг 1 раз в сутки. Пациентам моложе 60 лет и без серьёзной сопутствующей патологии допустима начальная доза 10 мг. Приём варфарина продолжают не менее 3 месяцев[21].
Цель реперфузионной терапии — удаление тромба и восстановление нормального лёгочного кровотока. Чаще всего для этого применяют тромболитическую терапию. Её рекомендуют проводить больным высокого риска. Некоторые авторы допускают применение тромболизиса при умеренном риске, однако польза такой терапии в этой группе больных в настоящее время не ясна[22]. Применяют следующие препараты:
- Стрептокиназа — нагрузочная доза 250 000 МЕ в течение 30 минут, затем 100 000 МЕ в час в течение 12—24 ч или ускоренная схема 1,5 млн МЕ в течение 2 ч
- Урокиназа — нагрузочная доза 4400 МЕ/кг массы тела в течение 10 мин, затем 4400 МЕ/кг массы тела в час в течение 12—24 ч или ускоренная схема 3 млн МЕ в течение 2 ч
- Альтеплаза — 100 мг на протяжении 2 ч или ускоренная схема 0,6 мг/кг массы тела на протяжении 15 мин (максимальная доза 50 мг)
Кровотечение — основная проблема тромболитической терапии. Массивное кровотечение развивается в 13 % случаев, в 1,8 % — внутримозговое кровоизлияние.
Хирургическое удаление тромба (тромбэктомия) рассматривают как альтернативный метод лечения ТЭЛА высокого риска, когда тромболитическая терапия противопоказана. Больным с высоким риском рецидива и при абсолютных противопоказаниях к антикоагулянтной терапии возможна установка кава-фильтров[23]. Они представляют собой сетчатые фильтры, которые улавливают отрывающиеся от стенки тромбы и предотвращают их попадание в лёгочную артерию. Кава-фильтр вводят чрескожно, чаще через внутреннюю яремную или бедренную вену, и устанавливают ниже почечных вен (выше — при наличии тромбов в почечных венах)[21].
Примечания
Ссылки
- Обучающий фильм Тромбоэмболия легочной артерии
- Диагностика и лечение тромбоэмболии легочной артерии на догоспитальном этапе (недоступная ссылка)
- Тромбоэмболия легочной артерии - медицинский образовательный портал kbmk.info
- http://www.noat.ru/ - сайт Национального общества по атеротромбозу, ресурс для профессионалов об антитромботической терапии (в том числе, ТЭЛА, венозного тромбоза)