Нарушения митохондриального бета-окисления жирных кислот
Наруше́ния митохондриа́льного бе́та-окисле́ния жи́рных кисло́т (НМБЖК) — это группа из 11 наследственных аутосомно-рецессивных заболеваний, обусловленных дефектами ферментов, ответственных либо за транспорт карнитина и жирных кислот в митохондрии, либо непосредственно за процесс бета-окисления. Клиническая картина крайне разнообразна: от жизнеугрожающих состояний у новорождённых, проявляющихся гипокетотической гипогликемией, энцефалопатией, дисфункцией печени и сердца, до менее тяжёлых форм с более поздним началом, для которых характерны мышечные боли и непереносимость физической нагрузки, причём выраженность симптомов может варьировать даже среди пациентов с идентичными генетическими мутациями[1][2].
Что важно знать
История
В 1950 году немецкий биохимик Феодор Феликс Конрад Линен из Мюнхенского университета раскрыл химические механизмы активации карбоновых кислот и метаболического расщепления жирных кислот в клетках, впоследствии названные спиралью Линена. В 1964 году он совместно с Конрадом Блохом получил Нобелевскую премию по физиологии и медицине за открытия, касающиеся механизма и регуляции метаболизма холестерина и жирных кислот[3].
Примерно через 20 лет после этого, в 1970 году, Энгель описал первый генетический дефект окисления жирных кислот, выявив заболевание скелетных мышц с перемежающимися симптомами и возможным нарушением липидного обмена. В 1973 году ДиМауро сообщил о первом идентифицированном ферментном дефекте — недостаточности карнитин-пальмитоилтрансферазы, проявляющейся рецидивирующей миоглобинурией[3][4].
Классификация
Согласно международной классификации болезней 10-го пересмотра НМБЖК относятся к нарушениям обмена жирных кислот (E71.3)[5].
Согласно международной классификации болезней 11-го пересмотра НМБЖК относятся к врождённым нарушениям окисления жирных кислот или обмена кетоновых тел (5C52.0Z)[6].
| Классификация нарушений митохондриального бета-окисления жирных кислот[1] | |
|---|---|
| Заболевание | Ген |
| Нарушения обмена карнитина | |
| Первичная недостаточность карнитина | SLC22A5 |
| Недостаточность карнитин пальмитоилтрансферазы I | CPT1A |
| Недостаточность карнитин-ацилкарнитин транслоказы | SLC25A20 |
| Недостаточность карнитин пальмитоилтрансферазы II | CPT2 |
| Нарушения митохондриального бета-окисления жирных кислот | |
| Недостаточность короткоцепочечной ацил-КоА дегидрогеназы | ACADS |
| Недостаточность среднецепочечной ацил-КоА дегидрогеназы | ACADM |
| Недостаточность очень длинноцепочечной ацил-КоА дегидрогеназы | ACADVL |
| Недостаточность короткоцепочечной 3-гидроксиацил-КоА дегидрогеназы | HADH (SCHAD) |
| Недостаточность длинноцепочечной 3-гидроксиацил-КоА дегидрогеназы | HADHA |
| Недостаточность митохондриального трифункционального белка | HADHA, HADHB |
| Глутаровая ацидемия, тип II (множественная недостаточность ацил-КоА дегидрогеназ) | ETFA, ETFB, ETFDH |
По ведущему симптомокомплексу, выделяют следующие формы НМБЖК[7]:
- системную с поражением сердца и печени;
- печёночную;
- миопатическую.
По срокам появления первых признаков различают формы НМБЖК[7]:
- неонатальную;
- детскую с манифестацией в первые два года жизни;
- позднюю.
Этиология
Этиология НМБЖК связана с генетическими мутациями, наследуемыми по аутосомно-рецессивному типу. К нарушениям обмена и транспорта карнитина приводят мутации в генах SLC22A5, CPT1A, SLC25A20 и CPT2, в то время как непосредственно дефекты митохондриального бета-окисления вызываются мутациями в генах ACADS, ACADM, ACADVL, HADH, HADHA, HADHB, ETFA, ETFB и ETFDH[1][7].
Патогенез
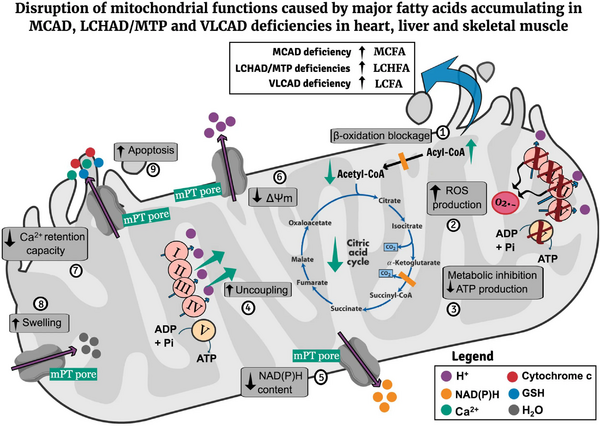
Патогенез НМБЖК формируется вокруг трёх взаимосвязанных процессов: энергетического дефицита, накопления токсичных метаболитов и вызванного ими окислительного стресса. Первичный блок в метаболическом пути приводит к неспособности использовать жиры для выработки энергии в критических состояниях, что вызывает опасную гипогликемию и энергетическое голодание тканей[8].
Ключевым повреждающим фактором является накопление специфичных ацилкарнитинов и жирных кислот. Эти соединения оказывают прямое токсическое действие на митохондрии, нарушая процессы окислительного фосфорилирования и выработки АТФ, что усугубляет энергетический кризис в клетках сердца, печени и скелетных мышц. Накопленные метаболиты запускают мощный окислительный стресс. В клетках повышается концентрация активных форм кислорода, истощаются антиоксидантные системы и происходит окислительное повреждение липидов, белков и ДНК. Это, в свою очередь, вызывает глубокое нарушение липидного состава клеточных мембран, меняя профиль фосфолипидов и сфинголипидов, что дополнительно дестабилизирует работу клеток[8][9].
Конечным результатом этого каскада нарушений становится повреждение и гибель клеток через механизмы апоптоза и некроза, что клинически проявляется в виде полиорганной патологии: миопатии, кардиомиопатии, печёночной дисфункции и неврологических расстройств[8][9].
Эпидемиология
Суммарная распространённость заболеваний группы НМБЖК оценивается в среднем как 1 случай на 9000 новорождённых, однако этот показатель может значительно варьировать в зависимости от этнической и географической популяции. Наиболее часто встречающимся заболеванием в данной группе является недостаточность среднецепочечной ацил-КоА-дегидрогеназы, её частота составляет от 1:14 600 до 1:20 000 живорождённых[7].
Диагностика
Клиническая картина НМБЖК обычно манифестирует или усугубляется в условиях повышенного катаболизма. К таким провоцирующим факторам относятся продолжительные или интенсивные физические нагрузки, интеркуррентные инфекции и голодание, которые усиливают распад длинноцепочечных жирных кислот[1].
Наиболее тяжёлые неонатальные и инфантильные формы проявляются острыми метаболическими кризами. Их симптомы включают вялость, сонливость, рвоту, судороги, дыхательную недостаточность вплоть до развития комы, что отражает гипокетотическую гипогликемическую энцефалопатию. Часто наблюдаются гепатомегалия, а также генерализованная мышечная гипотония и слабость. Поражение мышечной системы в виде миалгии и эпизодов рабдомиолиза характерно для ряда дефектов, затрагивающих метаболизм длинноцепочечных жирных кислот и транспорт карнитина. К ним относятся недостаточность карнитин-пальмитоилтрансферазы II, карнитин-ацилкарнитин транслоказы, очень длинноцепочечной ацил-КоА дегидрогеназы, митохондриального трифункционального белка, длинноцепочечной 3-гидроксиацил-КоА дегидрогеназы и глутаровой ацидемии типа II. Периферическая полинейропатия является специфичным проявлением при недостаточности митохондриального трифункционального белка и длинноцепочечной 3-гидроксиацил-КоА дегидрогеназы. Сердечно-сосудистые нарушения представляют серьёзную угрозу и включают кардиомиопатию и аритмии. Кардиомиопатия может развиваться при множественных формах, включая первичную недостаточность карнитина и различные дефекты длинноцепочечного окисления. Нарушения ритма сердца наиболее часто встречаются при недостаточности карнитин-пальмитоилтрансферазы II, карнитин-ацилкарнитин транслоказы и дефектах длинноцепочечных ферментов[1][7].
Заболевания могут сопровождаться и другими органными поражениями. Лицевые дисморфии характерны для недостаточности карнитин-пальмитоилтрансферазы II и глутаровой ацидемии типа II. Поражение почек, включая нефромегалию и кистозные изменения, характерны при тех же формах, а также при недостаточности карнитин-пальмитоилтрансферазы I. Пигментный ретинит является специфичным признаком для недостаточности митохондриального трифункционального белка и длинноцепочечной 3-гидроксиацил-КоА дегидрогеназы. Для глутаровой ацидемии типа II также характерен специфичный запах мочи[1].
Более лёгкие, так называемые миопатические или взрослые формы, обычно манифестируют в подростковом или взрослом возрасте. Они характеризуются непереносимостью физических нагрузок, эпизодами мышечной слабости, миалгии и рабдомиолиза, которые приводят к миоглобинурии и риску острой почечной недостаточности. У части таких пациентов также могут развиваться кардиомиопатия и нарушения ритма сердца[1].
Биохимический анализ крови: возможно повышение активности креатинфосфокиназы, аспартатаминотрансферазы, аланинаминотрансферазы, повышение концентрации глюкозы, лактата и мочевины. Особенно выраженные изменения определяются при кризах[2][7].
Клинический анализ мочи: возможна миоглобинурия[1].
Тандемная масс-спектрометрия позволяет оценить профиль ацилкарнитинов крови[2][7]
| Заболевание | Лабораторные исследования |
|---|---|
| Нарушения обмена карнитина | |
| Первичная недостаточность карнитина | Резкое снижение свободного карнитина (C0 < 10 мкмоль/л) и общих ацилкарнитинов (<5 мкмоль/л). |
| Недостаточность карнитин пальмитоилтрансферазы I | Повышение концентрации C0 и соотношения C0 / (C16 + C18). |
| Недостаточность карнитин-ацилкарнитин транслоказы | Снижение C0. Повышение C16, C16:1, C18, C18:1 и соотношения (C16 + C18:1) / C2. |
| Недостаточность карнитин пальмитоилтрансферазы II | Снижение C0. Повышение C16, C16:1, C18, C18:1 и соотношения (C16 + C18:1) / C2. |
| Нарушения митохондриального бета-окисления жирных кислот | |
| Недостаточность короткоцепочечной ацил-КоА дегидрогеназы | Повышение концентрации C4. |
| Недостаточность среднецепочечной ацил-КоА дегидрогеназы | Повышение концентрации C8, C10, C10:1. |
| Недостаточность очень длинноцепочечной ацил-КоА дегидрогеназы | Повышение концентрации C14:1 (основной маркер), C14, C16, C16:1, C12:1. |
| Недостаточность короткоцепочечной 3-гидроксиацил-КоА дегидрогеназы | Повышение концентрации C4-OH. |
| Недостаточность длинноцепочечной 3-гидроксиацил-КоА дегидрогеназы | Повышение концентрации C16:1-OH, C16-OH, C18:1-OH, C18-OH. |
| Недостаточность митохондриального трифункционального белка | Повышение концентрации C16:1-OH, C16-OH, C18:1-OH, C18-OH. |
| Глутаровая ацидемия, тип II (множественная недостаточность ацил-КоА дегидрогеназ) | Комбинированное повышение концентрации ацилкарнитинов разной длины цепи (C4, C5, C6, C8, C10, C12, C14, C16, C18). |
Для окончательной верификации диагноза пациентам проводится молекулярно-генетическое исследование методом секвенирования, направленное на выявление патогенных вариантов в соответствующих генах. Анализ позволяет обнаружить мутации, структурные перестройки и изменения числа копий генов, ответственных за развитие конкретного заболевания из этой группы[1][7].
Электрокардиография: возможно выявление нарушений ритма и проводимости сердца[1][7].
Эхокардиография: возможно выявление кардиомиопатии[1][7].
Офтальмоскопия: возможно выявление пигментного ретинита[1].
Дифференциальная диагностика
Дифференциальная диагностика НМБЖК зависит от возраста манифестации[1]:
- у новорождённых и детей раннего возраста необходимо исключать широкий спектр врождённых ошибок метаболизма и других состояний. К ним относятся аминоацидопатии, органические ацидурии, болезни митохондриальной дыхательной цепи, врождённые нарушения гликозилирования и пероксисомные заболевания. Также дифференциальный диагноз проводят с болезнями накопления гликогена, наследственными нарушениями обмена галактозы и фруктозы, кардиомиопатиями различного генеза, внутриутробными инфекциями, гепатитами и гипоксическим поражением центральной нервной системы;
- для взрослых (миопатических) форм круг заболеваний для дифференциации иной. Основные диагнозы-имитаторы включают мышечные формы гликогенозов (включая болезнь Помпе), структурные миопатии, мышечные дистрофии и митохондриальные миопатии, связанные с дефектами дыхательной цепи;
- особую группу составляют вторичные нарушения окисления жирных кислот, клинически и биохимически сходные с глутаровой ацидемией II типа. К ним относятся дефекты, связанные с метаболизмом рибофлавина (синдром Брауна — Виалетто — Ван Лаэра), недостаточность флавинадениндинуклеотид синтетазы и недостаточность митохондриального переносчика фолиевой кислоты
Лечение
Лечение НМБЖК носит комплексный характер и направлено на коррекцию метаболических нарушений, профилактику кризов и поддержание нутритивного статуса. Основу терапии составляет диетотерапия, главная цель которой заключается в предотвращении голодания, гипогликемии и снижение поступления патогенетически значимых жиров. Энергетические потребности покрываются преимущественно за счёт углеводов, которые подавляют катаболизм жиров. Для всех пациентов критически важно избегать длительных промежутков между приёмами пищи. У детей с тяжёлым течением для профилактики ночного голодания может использоваться кукурузный крахмал. Характер диеты зависит от формы заболевания: при дефектах длинноцепочечного окисления применяются специализированные смеси с высоким содержанием среднецепочечных триглицеридов, тогда как при дефиците среднецепочечной ацил-КоА-дегидрогеназы основной акцент делается на строгом режиме кормлений. При любом метаболическом стрессе (инфекция, рвота) необходимо немедленное увеличение потребления углеводов для предотвращения криза. При первых признаках криза назначаются растворы декстрозы При ухудшении состояния с отказом от еды и рвотой показана срочная госпитализация для инфузионной терапии[7].
Развитие криза является жизнеугрожающим состоянием и требует неотложной госпитализации и интенсивной терапии. Лечение направлено на устранение энергетического дефицита и детоксикацию[7]:
- Энергетическая поддержка: проводится внутривенное введение растворов декстрозы для купирования гипогликемии и подавления липолиза. Инфузия продолжается даже при нормальном уровне глюкозы для поддержания анаболизма.
- Коррекция метаболических нарушений: проводится лечение метаболического ацидоза (введение бикарбоната натрия), гипераммониемии (назначение препаратов, связывающих аммиак, таких как бензоат натрия) и водно-электролитных расстройств.
- Коррекция диеты: на время острого криза (24–48 часов) при тяжёлых формах полностью исключаются натуральные (длинноцепочечные) жиры, энергетическая ценность рациона повышается на 10-15% преимущественно за счёт углеводов. Питание обеспечивается через приемлемый для пациента энтеральный путь (перорально, через зонд).
Прогноз
Несмотря на значительный прогресс в диагностике и лечении, у пациентов сохраняется существенный риск развития опасных осложнений, прежде всего рабдомиолиза и кардиомиопатии. Прогноз во многом зависит от конкретной формы заболевания, тяжести метаболических нарушений, своевременности постановки диагноза и строгого соблюдения диеты, позволяющей в большинстве случаев предотвратить развитие жизнеугрожающих кризов. Тяжёлым и неблагоприятным исходом НМБЖК является синдром внезапной смерти младенца. Его развитие напрямую связано с острой метаболической декомпенсацией, возникающей в неонатальном периоде или на первом году жизни ребёнка[9].
Диспансерное наблюдение
Диспансерное наблюдение пациентов с НМБЖК носит пожизненный, регулярный и многопрофильный характер, направленный на контроль метаболического статуса, раннее выявление осложнений и коррекцию терапии. Наблюдение осуществляется командой специалистов, включающей врача-генетика, диетолога, педиатра или терапевта, кардиолога, невролога, офтальмолога, гастроэнтеролога и других профильных врачей по показаниям. Частота консультаций определяется индивидуально, но коррекция диетотерапии у детей раннего возраста проводится ежемесячно[7].
Мониторинг лабораторных показателей: ключевым параметром служит регулярное исследование профиля ацилкарнитинов и уровня свободного карнитина в крови для оценки эффективности диетотерапии. Частота анализов зависит от возраста: каждые 1–2 месяца у детей до года, каждые 3–6 месяцев до 6 лет и каждые 6–12 месяцев у пациентов старше 6 лет. Дополнительно проводятся расширенные биохимические исследования крови (включая печёночные ферменты, креатинкиназу, лактат, электролиты, липидный профиль) и клинические анализы крови и мочи не реже 1-2 раз в год, а также по показаниям при ухудшении состояния[7].
Инструментальный мониторинг направлен на выявление органных поражений. Всем пациентам показано ежегодное эхокардиографическое исследование и холтеровское мониторирование для своевременной диагностики кардиомиопатии и аритмий. Ультразвуковое исследование органов брюшной полости выполняется не реже одного раза в год для оценки состояния печени и почек. Регулярные осмотры офтальмолога (офтальмоскопия) необходимы для выявления пигментного ретинита. При наличии неврологической симптоматики проводится электроэнцефалография[7].
Профилактика
После установления диагноза семьям обязательно предлагается медико-генетическое консультирование. Поскольку все НМБЖК наследуются аутосомно-рецессивно, риск рождения больного ребёнка у здоровых родителей-носителей составляет 25%. Семьям объясняют механизм наследования и возможности планирования беременности. Для любой последующей беременности доступны методы пренатальной диагностики (исследование ДНК плода) и преимплантационной диагностики при использовании ЭКО, позволяющие предотвратить рождение ребёнка с тяжёлой формой заболевания[7].
С 2023 года в России проводится расширенный неонатальный скрининг, позволяющий выявить ряд этих заболеваний на доклинической стадии, что является первичной профилактикой тяжёлых осложнений. Важным аспектом вторичной профилактики является обучение пациентов и их семей правилам здорового образа жизни. Пациентам, особенно подросткам и взрослым, необходимо разъяснять риски, связанные с употреблением алкоголя, который нарушает глюконеогенез и может спровоцировать метаболический криз. Рекомендуется полное воздержание или строгое ограничение приёма алкоголя, только в сочетании с едой[7].
Примечания
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 Журкова Н. В., Вашакмадзе Н. Д., Сурков А. Н., и др. Нарушения митохондриального бета-окисления жирных кислот у детей: обзор литературы // Вопросы современной педиатрии. — 2022. — Т. 21, № 6S. — С. 522-528. — doi:10.15690/vsp.v21i6S.2503.
- ↑ 1 2 3 Vianey-Saban C., Fouilhoux A., Vockley J. et al. Improving diagnosis of mitochondrial fatty-acid oxidation disorders (англ.) // European Journal of Human Genetics. — 2023. — Vol. 31. — P. 265-272. — doi:10.1038/s41431-022-12.60-1.
- ↑ 1 2 Vianey-Saban C., Guffon N., Fouilhoux A., Acquaviva C. Fifty years of research on mitochondrial fatty acid oxidation disorders: The remaining challenges (англ.) // Journal of Inherited Metabolic Disease. — 2023. — Vol. 46, no. 5. — P. 848-873. — doi:10.1002/jimd.12664.
- ↑ Lipid Storage Myopathies Due to Fatty Acid Oxidation Defects (англ.). Neupsy Key. Дата обращения: 13 января 2026.
- ↑ Всемирная организация здравоохранения. Международная классификация болезней 10-го пересмотра (МКБ-10). МКБ 10 — Международная классификация болезней 10-го пересмотра. mkb-10.com (2026). Дата обращения: 13 января 2026.
- ↑ Всемирная организация здравоохранения. МКБ-11 для ведения статистики смертности и заболеваемости. МКБ-11 для ведения статистики смертности и заболеваемости. Всемирная организация здравоохранения (январь 2026). Дата обращения: 13 января 2026.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 Ассоциация медицинских генетиков, Союз педиатров России, Российское общество неонатологов. Нарушения митохондриального β-окисления жирных кислот (рус.). Рубрикатор клинических рекомендаций. Министерство Здравоохранения Российский Федерации (21 августа 2024). Дата обращения: 13 января 2026.
- ↑ 1 2 3 Guerra I. M. S., Ferreira H. B., Melo T. et al. Mitochondrial Fatty Acid β-Oxidation Disorders: From Disease to Lipidomic Studies—A Critical Review (англ.) // International Journal of Molecular Sciences. — 2022. — Vol. 23, no. 22. — P. 13933. — doi:10.3390/ijms232213933.
- ↑ 1 2 3 Merritt J. L. 2nd, Norris M., Kanungo S. Fatty acid oxidation disorders (англ.) // Annals of Translational Medicine. — 2018. — December (vol. 6, no. 24). — P. 473. — doi:10.21037/atm.2018.10.57.
Литература
- Merritt J. L. 2nd, Norris M., Kanungo S. Fatty acid oxidation disorders (англ.) // Annals of Translational Medicine. — 2018. — December (vol. 6, no. 24). — P. 473. — doi:10.21037/atm.2018.10.57.
- Guerra I. M. S., Ferreira H. B., Melo T. et al. Mitochondrial Fatty Acid β-Oxidation Disorders: From Disease to Lipidomic Studies—A Critical Review (англ.) // International Journal of Molecular Sciences. — 2022. — Vol. 23, no. 22. — P. 13933. — doi:10.3390/ijms232213933.
- Журкова Н. В., Вашакмадзе Н. Д., Сурков А. Н., и др. Нарушения митохондриального бета-окисления жирных кислот у детей: обзор литературы // Вопросы современной педиатрии. — 2022. — Т. 21, № 6S. — С. 522-528. — doi:10.15690/vsp.v21i6S.2503.