Миофибриллярные миопатии
Миофибрилля́рные миопати́и (ММ) — это группа наследственных заболеваний, при которых происходит поражение миокарда и скелетной мускулатуры. Эти патологии объединяет дезорганизация и распад миофибрилл с последующим аномальным внутриклеточным накоплением белков, структурно или функционально связанных с Z-дисками саркомера. Заболевание возникает в результате мутаций в различных генах, например DES, CRYAB, MYOT, LDB3, FLNC, BAG3 и другие[1][2].
История
Микроскопические изменения при ММ впервые описал Накашима в 1970 году. Эдстрём с соавторами в 1980 году отметили, что патологические включения в мышечных волокнах реагируют на десмин, что побудило Губеля предложить название «миопатии, связанные с десмином». Позднее исследователи пришли к пониманию, что описываемые патологические изменения затрагивают в первую очередь Z-диски миофибрилл. Бликер в 1996 году показал, что в поражённых волокнах накапливается целый ряд белков помимо десмина, таких как кристаллин, дистрофин, филамин, миотилин и амилоидные структуры, что послужило основанием для введения обобщающего термина «миофибриллярная миопатия»[2].
Классификация
Согласно международной классификации болезней 10-го пересмотра ММ относятся к первичным поражениям мышц (G71.8 - другие первичные поражения мышц)[3].
Согласно международной классификации болезней 11-го пересмотра ММ также относятся к первичным поражениям мышц (8C76)[4].
По этиологии заболевания выделяют 6 типов ММ[5][6]:
- Десминопатии.
- Альфа-B1-кристаллинопатии.
- Заспопатии.
- Миотилинопатии.
- Филаминопатии.
- BAG3-миопатии.
- Титинопатии.
Этиология
ММ представляют собой генетически гетерогенную группу заболеваний. Их этиология связана с мутациями в широком спектре генов, кодирующих белки, которые являются структурными компонентами или функционально ассоциированы с Z-диском саркомера. Основные гены, ассоциированные с этой патологией, включают DES, CRYAB, MYOT, LDB3, FLNC, BAG3, FHL1, TTN, PYROXD1 и KY. Кроме того, описаны случаи, когда гистологические изменения, характерные для ММ, вызывались мутациями в других генах, таких как ACTA1, HSPB8, PLEC, DNAJB6 и LMNA. Преобладающим типом наследования является аутосомно-доминантный, однако заболевание также может передаваться по аутосомно-рецессивному или сцепленному с X-хромосомой (доминантному или рецессивному) механизму[1].
Патогенез
Патогенез ММ напрямую зависит от конкретной генетической мутации, однако общим ключевым звеном является структурная нестабильность саркомера, возникающая из-за дефекта белков, связанных с Z-диском. Основу процесса составляет повреждение и последующий распад Z-дисков — структур, которые соединяют соседние саркомеры, обеспечивая целостность и прочность миофибрилл при сокращении. Это приводит к дезорганизации сократительного аппарата мышечного волокна и накоплению аномальных белковых агрегатов в цитоплазме, что в итоге нарушает нормальную функцию мышц. Определены следующие патогенетические механизмы
- при мутациях в генах DES, MYOT и LDB3 дефектные белки (десмин, миотилин и белок, связывающий домен LIM), в норме формирующие каркас Z-диска, теряют свою структуру и образуют патологические скопления внутри саркомера. Особенно тяжёлые кардиологические проявления характерны для дезминопатий, связанных с мутациями в гене DES;
- мутация в гене CRYAB, кодирующем белок альфа-B-кристаллин, нарушает его шаперонную функцию. В норме этот белок предотвращает агрегацию других белков, в частности, промежуточных филаментов. Его несостоятельность приводит к накоплению повреждённых белков;
- дефекты гена FLNC, кодирующего филамин-С, подрывают структурную целостность цитоскелета. Этот белок участвует в организации актиновой сети и обеспечивает связь саркомера с клеточной мембраной. Его мутации ведут к нестабильности мышечного волокна;
- гене BAG3 кодирует важный регуляторный белок, участвующий в селективной аутофагии — процессе утилизации повреждённых компонентов цитоскелета через лизосомы, а также в балансировании синтеза и распада белка. Нарушение этой функции приводит к накоплению клеточного детрита, массивной атрофии волокон и быстрому прогрессированию заболевания с ранним началом.
Эпидемиология
Точная распространённость ММ неизвестна, что связано с недостаточной изученностью этой группы заболеваний и частой недиагностированностью пациентов. Даже среди выявленных случаев генетические мутации удаётся обнаружить лишь примерно в половине, что указывает на существование ещё не открытых генов, ассоциированных с данной патологией. В российской медицинской литературе описаны лишь единичные случаи ММ, в том числе и семейные[2].
Диагностика
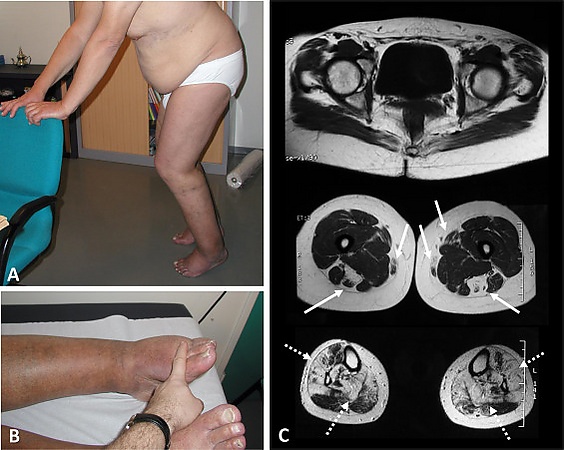
Клиническая картина ММ отличается значительным разнообразием симптомов, которое наблюдается даже среди родственников в одной семье. Заболевание может дебютировать в любом возрасте — от младенческого до пожилого, однако наиболее часто манифестация происходит в возрасте около 40 лет. У большинства пациентов первым признаком становится прогрессирующая мышечная слабость, изначально поражающая дистальные отделы конечностей: мышцы кистей, лодыжек и голеней. Это приводит к нарушению походки (степпаж) и трудностям при выполнении тонких движений руками. По мере развития болезни слабость распространяется на проксимальные мышцы бёдер, плечевого пояса, а также на мускулатуру спины и шеи. Частыми симптомами являются миалгии (мышечные боли), формирование контрактур суставов (особенно ахилловых сухожилий) и развитие сколиоза. У части больных заболевание может начинаться не с дистальных, а с аксиальных (центральных) мышц туловища[2].
При вовлечении бульбарной мускулатуры возникают нарушения глотания (дисфагия) и изменения голоса (дисфония, назализация речи). Поражение дыхательных мышц, в частности диафрагмы, ведёт к появлению одышки, ощущению нехватки воздуха и развитию дыхательной недостаточности. Вовлечение миокарда проявляется различными формами кардиомиопатии (дилатационной, гипертрофической, рестриктивной), нарушениями проводимости (атриовентрикулярные блокады, блокады ножек пучка Гиса), аритмиями и сердечной недостаточностью[2].
У значительной части пациентов отмечаются признаки периферической нейропатии, которые включают снижение чувствительности, ощущения онемения, покалывания (парестезии) и слабость в конечностях. В редких случаях, преимущественно связанных с мутациями в гене CRYAB, может развиваться катаракта[2].
Биохимический анализ крови: возможно повышение активности креатинфосфокиназы[2].
Гистологическое исследование биоптата мышечной ткани[5]:
- при световой микроскопии выявляется комплекс характерных, хотя и не строго специфичных, изменений. К ним относятся наличие аморфных, гранулярных или гиалиновых отложений разной формы и размера, которые окрашиваются трихромом. В очагах поражения, особенно в области гиалиновых структур, наблюдается снижение или полная потеря активности окислительных ферментов. Часто обнаруживаются вакуоли, как с ободком, так и без него, а также конгофильные отложения, ассоциированные с гиалиновыми включениями;
- при электронной микроскопии выявляется дезорганизация миофибрилл, начинающаяся с разрушения Z-дисков, и очаговые скопления деградировавших элементов миофибрилл среди сохранившихся миофиламентов. Ни один из этих признаков в отдельности не является патогномоничным.
Иммуногистохимическое исследование биоптата мышечной ткани: характерна экспрессия множества белков в цитоплазме мышечных волокон, таких как десмин, альфа-B-кристаллин, дистрофин, миотилин, саркогликаны, молекула адгезии нервных клеток, плектин, гельзолин, убиквитин или филамин-С
Гистологическое исследование периферических нервов: характерно накопление нейрофиламентов, нейротрубочек и образование аксональных сфероидов[2].
Молекулярно-генетический анализ методов секвенирования позволяет выявить мутацию в конкретном гене[2].
При магнитно-резонансной томографии у пациентов с ММ выявляются характерные дистрофические изменения скелетной мускулатуры, которые проявляются в виде замещения мышечной ткани жировой и фиброзной (фиброзно-жировой инфильтрации). Этот процесс часто носит асимметричный характер[6].
При электронейромиографии выявляются признаки миопатии: снижение амплитуды и полифазность потенциалов двигательных единиц, а также патологическая спонтанная активность (фибрилляции, положительные острые волны, миотонические разряды) в покое[2].
Дифференциальная диагностика
Дифференциальная диагностика ММ проводится со следующими заболеваниями[7][8]:
- синдром Гийена — Барре;
- синдром Ламберта — Итона;
- миастения;
- оссифицирующий миозит;
- миозит, ассоциированный с васкулитами;
- паранеопластические синдромы (например, карциноматозная нейропатия, кахексия, мионекроз);
- спорадический миозит с включениями;
- миотоническая дистрофия;
- миопатия Нонаки.
Осложнения
Лечение
Терапия ММ является симптоматической и подбирается строго индивидуально. Для общей поддержки организма могут назначаться витамины. При выраженной мышечной слабости основой лечения становится физиотерапия. При прогрессировании заболевания, угрожающем развитием дыхательной и сердечной недостаточности, а также при тяжёлых ортопедических осложнениях (выраженный сколиоз, вывихи суставов) выполняются реконструктивные хирургические операции. При нарушения ритма и проводимости сердца может потребоваться установка кардиостимулятора или имплантируемого кардиовертера-дефибриллятора, а в жизнеугрожающих случаях — трансплантации сердца. При развитии тяжёлой дыхательной недостаточности необходима респираторная поддержка, вплоть до искусственной вентиляции лёгких. Ведутся исследования, изучающие потенциальную возможность применения метформина для восстановления мышечной функции у пациентов с ММ, вызванной мутацией в гене BAG3[2][6].
Прогноз
Прогноз при ММ вариабелен и в значительной степени определяется конкретным генетическим подтипом заболевания и степенью вовлечения жизненно важных систем. Наиболее серьёзное влияние на продолжительность и качество жизни оказывает прогрессирующее поражение сердечной мышцы (кардиомиопатия, нарушения ритма) и дыхательная недостаточность, которые могут приводить к инвалидизации и преждевременной смерти. Течение болезни обычно медленно прогрессирующее, однако скорость нарастания симптомов может различаться даже среди членов одной семьи[5].
Диспансерное наблюдение
Пациенты с ММ нуждаются в диспансерном наблюдении невролога, кардиолога и пульмонолога. Объём и частота контрольных обследований определяется индивидуально[2].
Профилактика
Генетическое консультирование является ключевым методом профилактики и планирования семьи для родственников пациентов с ММ. В ходе консультации определяется риск наследования мутации, объясняется вариабельный характер течения болезни и проводятся необходимые генетические тесты. Это позволяет потенциальным носителям патогенного варианта гена принять информированное репродуктивное решение, например, воспользоваться методами пренатальной или преимплантационной генетической диагностики[2].
Примечания
- ↑ 1 2 Luo Y. B., Peng Y., Lu Y. et al. Expanding the Clinico-Genetic Spectrum of Myofibrillar Myopathy: Experience From a Chinese Neuromuscular Center (англ.) // Frontiers in Neurology. — 2020. — 15 September (vol. 11). — P. 1014. — doi:10.3389/fneur.2020.01014.
- ↑ 1 2 3 4 5 6 7 8 9 10 11 12 13 14 Невядомская В. С. Миофибриллярные миопатии (рус.). Генокарта - генетическая энциклопедия (11 марта 2022). Дата обращения: 12 января 2026.
- ↑ Всемирная организация здравоохранения. Международная классификация болезней 10-го пересмотра (МКБ-10). МКБ 10 — Международная классификация болезней 10-го пересмотра. mkb-10.com (2026). Дата обращения: 12 января 2026.
- ↑ Всемирная организация здравоохранения. МКБ-11 для ведения статистики смертности и заболеваемости. МКБ-11 для ведения статистики смертности и заболеваемости. Всемирная организация здравоохранения (январь 2026). Дата обращения: 09 января 2026.
- ↑ 1 2 3 Béhin A., Salort-Campana E., Wahbi K. et al. Myofibrillar myopathies: State of the art, present and future challenges (англ.) // Revue Neurologique. — 2015. — October (vol. 171, no. 10). — P. 715-729. — doi:10.1016/j.neurol.2015.06.002.
- ↑ 1 2 3 4 Angelini C., Ceolin C., Rodriguez A. A., Nigro V. Two Cases of Myofibrillar Myopathies: Genetic and Quality of Life Study (англ.) // Muscles. — 2023. — Vol. 2, no. 2. — P. 177-186. — doi:10.3390/muscles2020013.
- ↑ Nagy A., Veerapaneni K. D. Myopathy (англ.). Statpearls (14 августа 2023). Дата обращения: 12 января 2026.
- ↑ Myofibrillar Myopathy (англ.). Nationa Organization For Rare Disorders (29 июня 2021). Дата обращения: 12 января 2026.
Литература
- Angelini C., Ceolin C., Rodriguez A. A., Nigro V. Two Cases of Myofibrillar Myopathies: Genetic and Quality of Life Study (англ.) // Muscles. — 2023. — Vol. 2, no. 2. — P. 177-186. — doi:10.3390/muscles2020013.
- Béhin A., Salort-Campana E., Wahbi K. et al. Myofibrillar myopathies: State of the art, present and future challenges (англ.) // Revue Neurologique. — 2015. — October (vol. 171, no. 10). — P. 715-729. — doi:10.1016/j.neurol.2015.06.002.
- Luo Y. B., Peng Y., Lu Y. et al. Expanding the Clinico-Genetic Spectrum of Myofibrillar Myopathy: Experience From a Chinese Neuromuscular Center (англ.) // Frontiers in Neurology. — 2020. — 15 September (vol. 11). — P. 1014. — doi:10.3389/fneur.2020.01014.