Синдром Уокера — Варбурга
Синдро́м Уо́кера — Ва́рбурга (лиссэнцефали́я 2-го ти́па, синдро́м HARDE, синдро́м окуло-церебра́льной дисплази́и — мы́шечной дистрофи́и) – это тяжёлое наследственное заболевание, проявляющееся сочетанными пороками развития центральной нервной системы и глаз и мышечной дистрофией. Основными клиническими признаками являются нарушение формирования извилин головного мозга (лиссэнцефалия), различные аномалии структур глаза, а также врождённая мышечная дистрофия. Патология связана с мутациями в генах, кодирующих белки, которые необходимы для нормального гликозилирования альфа-дистрогликана — ключевого компонента для стабильности клеточных мембран. Заболевание отличается крайне неблагоприятным прогнозом и в большинстве случаев приводит к гибели ребёнка на первом году жизни[1].
Что важно знать
История
История СУВ начинается с описания, сделанного американским нейрохирургом Артуром Эрлом Уокером в 1942 году, который первым описал характерную лиссэнцефалию у родных брата и сестры. Позднее, в 1970-х годах, датский офтальмолог Метте Варбург представила серию наблюдений за пациентами с этим заболеванием, что дополнило клиническую картину. В 1989 году исследователь Добинс систематизировал проявления болезни и предложил использовать для её обозначения акроним HARDE, отражающий ключевые симптомы: гидроцефалию, агирию, дисплазию сетчатки и энцефалоцеле. Молекулярно-генетический этап изучения синдрома начался в конце XX века. Первый ассоциированный ген POMT1 был картирован в 1999 году, а в начале 2000-х годов были идентифицированы и другие ответственные гены, такие как FKRP и POMT2, что позволило установить генетическую основу заболевания[1].
Классификация
Согласно международной классификации болезней 10-го пересмотра СУВ относится к мышечным дистрофиям (G71.0)[2].
Согласно международной классификации болезней 11-го пересмотра СУВ относится к врождённым миодистрофиям (8C70.6)[3].
Этиология
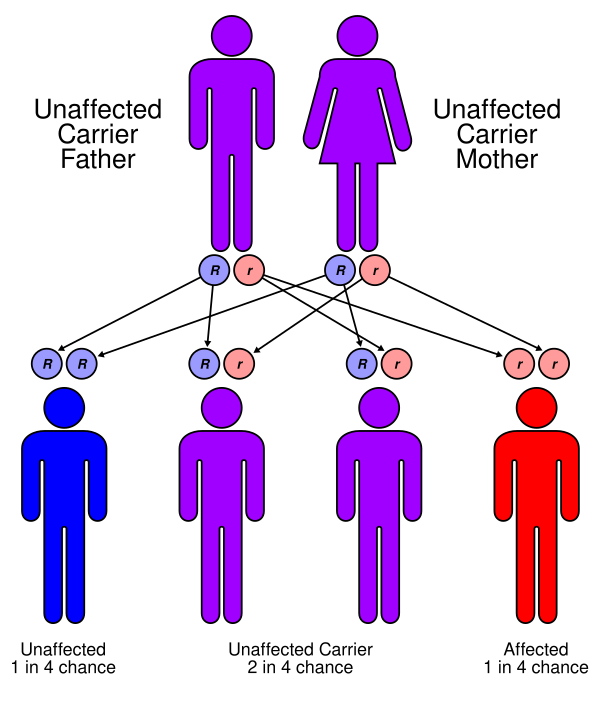
СУВ имеет генетическую природу и возникает вследствие мутаций в генах, кодирующих белки, необходимые для процесса O-маннозного гликозилирования альфа-дистрогликана. Нарушение этого ключевого посттрансляционного процесса приводит к дефектам в структуре мышечной и нервной ткани. Наиболее частой причиной заболевания являются мутации в генах POMT1 и POMT2, кодирующих O-маннозилтрансферазы, а также в гене FKRP. Значительную роль также играют мутации в других генах этого же метаболического пути, таких как FKTN, LARGE и POMGNT1. Всего с развитием синдрома ассоциировано более десятка генов, что подчёркивает его значительную генетическую гетерогенность. В редких случаях фенотип, сходный с СУВ, может быть вызван мутациями в генах, не связанных напрямую с гликозилированием дистрогликана, например, в гене COL4A1. Заболевание может проявляться как в виде спорадических, изолированных случаев, так и иметь семейный характер. В последнем случае синдром наследуется по аутосомно-рецессивному механизму[1][4].
Патогенез
Ключевое звено в развитии СУВ — нарушение функции белка альфа-дистрогликана, который является центральным компонентом дистрофин-гликопротеинового комплекса, стабилизирующего клеточные мембраны. Его нормальное функционирование критически зависит от правильного гликозилирования, в процессе которого к белковой основе присоединяются специфические углеводные цепи. Эти гликановые структуры выполняют роль связующего моста между внутриклеточным цитоскелетом и белками внеклеточного матрикса, в первую очередь ламинином. При СУВ генетические дефекты приводят к нарушению именно этого процесса O-гликозилирования. В результате альфа-дистрогликан теряет способность формировать прочные связи с ламинином. Это разрушает структурную целостность базальной мембраны, нарушает механическую стабильность клеток и их адгезию к внеклеточному матриксу. Такая патология интеграции мембран лежит в основе двух главных проявлений болезни: прогрессирующей врождённой мышечной дистрофии из-за нестабильности мышечных волокон и тяжёлых пороков развития головного мозга, возникающих в процессе эмбриогенеза[1].
Эпидемиология
СУВ относится к категории редких наследственных заболеваний. По имеющимся данным, его распространённость в популяции оценивается приблизительно в 1-2 случая на 100 000 новорождённых[4].
Диагностика
Клиническая картина СУВ характеризуется тяжёлыми полиорганными нарушениями, манифестирующими с рождения или в раннем неонатальном периоде. Родители обращают внимание на выраженную вялость, генерализованную мышечную гипотонию и грубое отставание в психомоторном развитии ребёнка. Практически всегда синдром сопровождается гидроцефалией. В половине случаев выявляется комплекс Дэнди — Уокера — аномалия развития мозжечка и ликворных путей. Примерно у четверти пациентов наблюдается микроцефалия, а у 40% — энцефалоцеле (черепно-мозговая грыжа). Со стороны органов зрения присутствуют множественные пороки развития: дисплазия сетчатки, микрофтальм, помутнение роговицы и врождённая катаракта. Помимо этого, могут встречаться и другие аномалии, такие как расщелина неба, микрогнатия, косолапость и атрезия ануса[1].
При магнитно-резонансной томографии головного мозга у всех пациентов с СУВ выявляется лиссэнцефалия II типа (так называемая "булыжная мостовая" кора). Исследование также может демонстрировать сопутствующие тяжёлые структурные аномалии, включая гидроцефалию, энцефалоцеле, выраженную гипоплазию ствола мозга и мозжечка, вплоть до формирования мальформации Дэнди — Уокера. У части больных отмечается агенезия мозолистого тела. Кроме того, в белом веществе головного мозга часто наблюдаются диффузные изменения сигнала, свидетельствующие о его патологии[4].
Офтальмоскопия: к характерным дефектам относятся дисплазия сетчатки, которая может приводить к её отслойке, врождённая катаракта, микрофтальмия и микрокорнеа[5].
Биохимический анализ крови: характерно повышение активности креатинфосфокиназы[5].
Молекулярно-генетический анализ методом секвенирования: позволяет выявить мутации в генах, вызывающих развитие СУВ[5].
При ультразвуковом исследовании плода определяются неспецифичные, но характерные аномалии развития центральной нервной системы плода. Основными маркерами являются вентрикуломегалия, лиссэнцефалия и гипоплазия мозжечка. Патогномоничным ультразвуковым признаком считается обнаружение аномально изогнутого, Z-образного ствола мозга, который сохраняет эмбриональную форму из-за нарушения процессов миграции нейронов. Этот ствол мозга часто окружён эхогенной полосой. Сопутствующими находками являются гипоплазия червя мозжечка, которая может сочетаться с полимикрогирией и кистами, а также видимое увеличение объёма головного мозга со сглаживанием мозговых борозд и щелей[6].
Дифференциальная диагностика
Дифференциальную диагностику СУВ необходимо проводить с другими формами врождённых мышечных дистрофий и миопатий, которые также могут сопровождаться лиссэнцефалией II типа (например, врождённая мышечная дистрофия Фукуямы). Кроме того, схожие клинические проявления наблюдаются при некоторых хромосомных аномалиях, в частности при трисомии 13 (синдром Патау) и 18 (синдром Эдвардса), а также при множественных врождённых синдромах, сочетающихся с пороками развития головного мозга. Отдельно следует исключать последствия внутриутробных инфекций (TORCH-синдром), способных вызывать гидроцефалию, задержку внутриутробного роста плода и катаракту, имитирующие симптомы данного синдрома[4].
Лечение
Специфическое лечение данного заболевания отсутствует. Ведение пациентов является исключительно поддерживающим и симптоматическим. Части пациентам требуется хирургическое вмешательство для лечения гидроцефалии или энцефалоцеле[4].
Прогноз
СУВ характеризуется крайне неблагоприятным прогнозом. Подавляющее большинство детей с этим диагнозом погибает в течение первых месяцев жизни[1].
Диспансерное наблюдение
Не разработано.
Профилактика
В связи с отсутствием эффективного лечения первостепенное значение приобретает профилактика, основанная на медико-генетическом консультировании. Эта мера особенно важна для супружеских пар из группы риска, в частности, имеющих отягощённый семейный анамнез или уже родивших ребёнка с подобным заболеванием[1][4].
Примечания
- ↑ 1 2 3 4 5 6 7 Гамисония А. М. Синдром Уокера – Варбурга (рус.). Генокарта - генетическая энциклопедия (27 января 2020). Дата обращения: 8 января 2025.
- ↑ Всемирная организация здравоохранения. Международная классификация болезней 10-го пересмотра (МКБ-10). МКБ 10 — Международная классификация болезней 10-го пересмотра. mkb-10.com (2026). Дата обращения: 08 января 2026.
- ↑ Всемирная организация здравоохранения. МКБ-11 для ведения статистики смертности и заболеваемости. МКБ-11 для ведения статистики смертности и заболеваемости. Всемирная организация здравоохранения (январь 2026). Дата обращения: 08 января 2026.
- ↑ 1 2 3 4 5 6 Bertini E. Walker-Warburg syndrome (англ.). Orphanet (январь 2023). Дата обращения: 8 января 2026.
- ↑ 1 2 3 Aref F., Shaaban A., Ahmed A. et al. Walker-Warburg syndrome: A case report of congenital muscular dystrophy with hydrocephalus (англ.) // Radiology Case Reports. — 2024. — 20 August (vol. 19, no. 11). — P. 5063-5065. — doi:10.1016/j.radcr.2024.07.149.
- ↑ Castro P. T., Fazecas T., Matos A. P. P. et al. Prenatal diagnosis of Walker–Warburg syndrome: ultrasound, magnetic resonance imaging and three-dimensional reconstruction (англ.) // Ultrasound in Obstetrics & Gynecology. — 2024. — Vol. 64. — P. 699-701. — doi:10.1002/uog.27648.
Литература
- Castro P. T., Fazecas T., Matos A. P. P. et al. Prenatal diagnosis of Walker–Warburg syndrome: ultrasound, magnetic resonance imaging and three-dimensional reconstruction (англ.) // Ultrasound in Obstetrics & Gynecology. — 2024. — Vol. 64. — P. 699-701. — doi:10.1002/uog.27648.
- Aref F., Shaaban A., Ahmed A. et al. Walker-Warburg syndrome: A case report of congenital muscular dystrophy with hydrocephalus (англ.) // Radiology Case Reports. — 2024. — 20 August (vol. 19, no. 11). — P. 5063-5065. — doi:10.1016/j.radcr.2024.07.149.