Туберкулёз
Туберкулёз (от лат. tuberculum — бугорок) — широко распространённое в мире инфекционное заболевание человека и животных, вызываемое различными видами микобактерий из группы Mycobacterium tuberculosis complex (M. tuberculosis и другими близкородственными видами), или иначе палочками Коха[1][2][3]. Туберкулёз обычно поражает лёгкие, реже затрагивая другие органы и системы. Mycobacterium tuberculosis передаётся воздушно-капельным путём при разговоре, кашле и чихании больного[4]. Чаще всего после инфицирования микобактериями заболевание протекает в бессимптомной, скрытой форме (тубинфицированность), но примерно один из десяти случаев скрытой инфекции, в конце концов, переходит в активную форму[5]. Для человека заболевание является социально зависимым[6].
Устаревшее название туберкулёза лёгких — чахо́тка (от слова чахнуть). В качестве названия туберкулёза почек и некоторых других внутренних паренхиматозных органов (печени, селезёнки), а также желёз (например, слюнных) ранее использовалось слово «бугорчатка». Наружный туберкулёз (кожи, слизистых, лимфоузлов) назывался золотухой.
До XX века туберкулёз был практически неизлечим. В настоящее время разработана комплексная программа, позволяющая выявить и вылечить заболевание на ранних стадиях его развития[7][8].
Область медицины, занимающаяся туберкулёзом, называется фтизиатрией, а её специалистов называют фтизиатрами.
Классические симптомы туберкулёза лёгких — длительный кашель с мокротой, иногда с кровохарканьем, появляющимся на более поздних стадиях, длительная субфебрильная температура, лихорадка, слабость, ночная потливость, пониженный аппетит и, как следствие, значительное похудение.
Что важно знать
Исторические сведения
Предположительно туберкулёз у животных выявлялся ещё 245 миллионов лет назад[11].
Самая древняя находка, связанная с проявлением туберкулёза у человека, принадлежала Паулю Бартельсу. Им в 1907 году было описано туберкулёзное поражение грудных позвонков с образованием горба у скелета, который был найден вблизи Гейдельберга и принадлежал человеку, жившему за 5 000 лет до н. э[12].
Одно из ранних указаний на туберкулёз встречается в вавилонских законах (начало II тысячелетия до н. э.), в которых давалось право на развод с женщиной, больной туберкулёзом. В древней Индии уже знали, что туберкулёз передаётся от одного члена семьи к другому, о нём говорится в Ведах, причём Аюрведа уже правильно рекомендовал горный воздух для лечения. В законах Ману (древняя Индия) запрещалось жениться на женщине из семей, где кто-то был болен туберкулёзом.
В древнем Египте отмечали, что чахотка чаще наблюдается среди рабов и редко среди привилегированных слоёв населения. Чахотку в Египте называли «семитской» болезнью, так как древний Ближний Восток, где жили семиты, был порабощён Египтом, и, как повествуют источники и Библия, (белые) семиты в Египте были рабами.
Описание туберкулёза имеется в медицинских трудах древнего Китая (V—VI вв. до н. э.).
В древней Греции (VI—IV вв. до н. э.) существовала известная Косская школа (Гиппократ), ей была знакома картина туберкулёза лёгких. Знаменитый труд от имени Гиппократа называет туберкулёз самой распространённой болезнью в его время, поражающей людей обычно в возрасте 18—35 лет, и содержит подробное описание комплекса симптомов туберкулёза лёгких: лихорадку, озноб, поты, кашель, боли в груди, мокроту, исхудание, упадок сил, отсутствие аппетита и общий вид больного туберкулёзом — habitus phtisicus. Среди так называемых чахоточных больных, очевидно, было немало страдавших пневмониями, абсцессами, раком, сифилисом и другими болезнями. Но, безусловно, среди них преобладали больные туберкулёзом. Это был так называемый эмпирический период медицины. Диагноз чахотки устанавливался при помощи простейших методов объективного исследования. Гиппократ учил: «Суждения делаются посредством глаз, ушей, носа, рта и других известных нам способов, то есть взглядом, осязанием, слухом, обонянием, вкусом». Он ввёл в практику непосредственную аускультацию грудной клетки. Хотя Гиппократ не упоминает о заразности туберкулёза, в основном говорится о наследственности, Исократ (390 г. до н. э.), даже не будучи врачом, уже пишет о заразности этого заболевания. На заразности туберкулёза настаивал и Аристотель. Древнегреческие врачи лечили туберкулёз, рекомендовали соблюдать режим, усиленное питание, назначали отхаркивающие средства, тёплые ванны.
В Древнем Риме в I веке н. э. Аретей из Каппадокии даёт описание phthisis (др.-греч. φθίσις — чахотка), сохранившее своё значение на все последующие тысячелетия. Во II веке н. э. известный римский врач Гален относил туберкулёз к позже названным кавернами изъязвлениям лёгких, рекомендует опиум для облегчения страданий, кровопускания, диету из ячменной настойки, фруктов и рыбы.
Ещё дальше продвинулись врачи средневекового Востока, подробно описав клинику туберкулёза (Авиценна, 980—1037 гг.). В «Каноне врачебной науки» Авиценна (Абу-Али Ибн-Сина) говорит о чахотке как болезни, переходящей на других и передающейся по наследству, доказав заражение туберкулёзом «испорченным воздухом», то есть заразным воздухом или воздушно-капельным путём. Авиценна признавал влияние внешней среды на течение заболевания, рекомендовал различные приёмы врачевания, в частности, правильное питание.
Вскрытие трупов до XVI века в Западной Европе запрещалось. Первые вскрытия, сведения о которых известны, были проведены в XIII веке, когда император Фридрих II разрешил вскрывать один труп в 5 лет, но затем последовал строгий запрет Римского папы. До XVI века спорадически разрешались вскрытия: в Монпелье — трупов казнённых, в Венеции — один труп в год. До XVI века представление о туберкулёзе в Европе были весьма примитивными. И только в Малой Азии (территория нынешней Турции) и в мавританской Испании врачи проводили регулярные исследования на трупах.
В 1540 году Фракасторо указывал, что основным источником распространения чахотки является больной человек, выделяющий мокроту, частицами которой заражаются воздух, бельё, посуда, жилище.
В XVI веке о болезнях лёгких у горняков сообщали немецкие медики Агрикола и Парацельс.
В XVII веке Франциск Сильвий впервые связал гранулёмы, обнаруженные в различных тканях при вскрытии трупа, с признаками чахотки.
В 1700 году вышла в свет книга итальянского врача Бернардино Рамадзини «О болезнях ремесленников», сообщающая о многочисленных вредных профессиях и связанных с ними болезнях органов дыхания, часть которых теперь известна как проявления запущенного туберкулёза лёгких или как отдельные нозологические формы туберкулёза, и утвердившая понимание туберкулёза как болезни рабочих. В 1720 году британский врач выпускник медицинского факультета университета Абердина Бенджамин (Вениамин) Мартен издаёт книгу о своей новой теории туберкулёза как болезни, вызываемой микробами, которых он наблюдал в мокроте больных[13].
В Испании в 1751 году, затем в Италии, Португалии были изданы законы об обязательной регистрации всех заболевших лёгочной чахоткой и их госпитализации, дезинфекции их жилищ, уничтожение одежды, предметов домашнего обихода. За невыполнение указанных постановлений врачей облагали штрафом или высылали из страны.
В 1779 году английский хирург Персивалл Потт описал клинику туберкулёза позвоночника («поттов горб»)[14].
В начале XIX века Рене Лаэннек предложил стетоскоп и описал бугорок туберкулёза, заявив о его излечимости. С 1820-х годов утвердилось понимание единства всех видов туберкулёза. Публичность темы туберкулёза и разоблачение предрассудков о способности коронованных особ лечить туберкулёз приводит к пониманию смысла избитой фразы «Чахотка воюет с хижинами, но щадит дворцы»: она означает только то, что в хижинах вымирают целыми семьями, а во дворцах погибают члены семей[15].
При лечении больных туберкулёзом в XIX веке использовались в основном гигиенические мероприятия, диетотерапия, санаторно-курортные факторы. Но в 1835—1842 годах неудачная попытка лечения туберкулёза поселением больных в Мамонтовой пещере, где они умирали значительно раньше, чем на поверхности, — никто не прожил и год — утвердила понимание, что туберкулёз — болезнь власти тьмы в самом буквальном смысле[16].
В 1819 году французский врач Рене Лаэннек предложил метод аускультации лёгких, что имело большое значение в разработке методов диагностики туберкулёза.
В 1822 году английский врач Джеймс Карсон высказал идею и предпринял первую, правда, неудачную, попытку лечения лёгочного туберкулёза искусственным пневмотораксом (введением воздуха в плевральную полость)|[17]. Спустя шесть десятилетий, в 1882 году, итальянцу Карло Форланини удалось ввести этот метод в практику. В России искусственный пневмоторакс впервые применил Аркадий Рубель в 1910 году.
В 1839 году Иоганн Лукас Шёнлейн предложил термин «туберкулёз»[18].
В 1854 году Герман Бремер с помощью жены своего брата графини Марии фон Колумб, племянницы фельдмаршала Блюхера, открыл первый туберкулёзный санаторий в Соколовско (теперь Польша), названном в честь ближайшего сподвижника Бремера польского врача Альфреда Соколовского. В санатории была воздвигнута православная часовня, что, видимо, свидетельствует о лечении русских больных. Методы лечения этого санатория затем использовались в Давосе и по всему миру[19].
Развитие научного учения о туберкулёзе началось в России в XIX веке. Николай Пирогов в 1852 году описал «гигантские клетки» в туберкулёзном очаге. Больших успехов добился Сергей Боткин, в частности, успешно лечивший императрицу Марию Александровну, жену императора Александра II и мать императора Александра III. Климатолечение туберкулёза в Крыму, существовавшее ещё в Средневековье, во многом благодаря Боткину получило научное обоснование.
В 1865 году французский морской врач Жан-Антуан Вильмен описал, как после распространения эпидемии на корабле вследствие наличия одного больного туберкулёзом он для доказательства инфекционной природы заболевания собирал мокроту больных и пропитывал ею подстилку для морских свинок. Свинки заболевали туберкулёзом и умирали от него. Так Вильмен экспериментально доказал, что туберкулёз — заразная («вирулентная») болезнь. Инфекционную природу туберкулёза подтвердил немецкий патолог Юлиус Конгейм в 1879 году. Он помещал кусочки органов больных туберкулёзом в переднюю камеру глаза кролика и наблюдал образование туберкулёзных бугорков.
В 1868 году немецкий патолог Теодор Лангганс обнаружил в туберкулёзном бугорке гигантские клетки, ранее обнаруженные Пироговым, но позже названные в честь Лангганса, так как он не был знаком с трудами Пирогова.
Облик фтизиатрии преобразовала деятельность Роберта Коха, открывшего возбудитель туберкулёза, и его доклад 24 марта 1882 года: «Пока имеются на земле трущобы, куда не проникает луч солнца, чахотка и дальше будет существовать. Солнечные лучи — смерть для бацилл туберкулёза. Я предпринял свои исследования в интересах людей. Ради этого я трудился. Надеюсь, что мои труды помогут врачам повести планомерную борьбу с этим страшным бичом человечества».
В 1882 году в Германии Роберт Кох после 17 лет работы в лаборатории открыл возбудителя туберкулёза, которого назвали бациллой Коха (БК). Он обнаружил возбудителя при микроскопическом исследовании мокроты больного туберкулёзом после окраски препарата везувином и метиленовым синим. Впоследствии он выделил чистую культуру возбудителя и вызвал ею туберкулёз у подопытных животных. В настоящее время фтизиатры пользуются термином МБТ (микобактерия туберкулёза).
Доклад Коха был напечатан в немецком медицинском журнале 10 апреля, а подробнейшие отчёты в английской «Times» — 22 апреля и в американской «New York Times» — в центре глобальной пандемии туберкулёза — 3 мая 1882 года[20]. Благодаря публикации 3 мая 1882 года Эндрю Карнеги выделил Коху деньги на создание института Роберта Коха. В США в начале XX века 80 % населения заражалось ещё в возрасте до 20 лет, и туберкулёз был главной причиной смертности[21]. Именно дата 3 мая совпала с датой основания Лиги по борьбе с туберкулёзом в России 3 мая 1910 года по новому стилю и первым Днём белой ромашки в России 3 мая 1911 года по новому стилю. С 1884 года Роберт Кох — иностранный член Санкт-Петербургской Академии наук[15].
До своего триумфа Коху пришлось выдержать борьбу с Рудольфом Вирховым, слишком буквально понимавшим социальные болезни как неинфекционные, вирулентность которых Вирхов объяснял наличием образующихся при недостатке света, свежего воздуха и питательных веществ вирулентных белков, подобных позднее открытым прионам. Но Кох, вначале признавая Mycobacterium bovis возбудителем туберкулёза человека тоже, затем изменил своё мнение и с упрямством, достойным лучшего применения, долго отрицал возможность поражения человека микобактериями бычьего туберкулёза, в результате чего тормозилось внедрение пастеризации молока, и многие заболели при употреблении некипячёного и непастеризованного молока, и неосторожно хвалил туберкулин как возможное средство профилактики и лечения туберкулёза, что было понято не как «возможное». Неоправдавшиеся ожидания больных и врачей подорвали авторитет Коха. Поэтому Кох получил Нобелевскую премию только в 1905 году. Кох считается основателем не только современной медицинской бактериологии, но и — вместе с Рудольфом Вирховым — современных общественного здравоохранения и гигиены. Благодаря их деятельности была прекращена квартальная застройка и резко ограничена уплотнительная застройка.
В 1882—1884 годах Франц Циль и Фридрих Нельсен (Германия) предложили эффективный метод окраски кислотоустойчивых микобактерий туберкулёза.
В 1887 году в Эдинбурге (Шотландия) был открыт первый противотуберкулёзный диспансер (от фр. dispenser — избавлять, освобождать). В этом новом учреждении оказывалась больным не только медицинская, но и социальная помощь. Затем диспансеры были созданы и в других европейских странах, в том числе, в России.
В 1890 году Роберт Кох впервые получил туберкулин, который описал как «водно-глицериновую вытяжку туберкулёзных культур». В диагностических целях Кох предложил делать подкожную пробу с введением туберкулина. На конгрессе врачей в Берлине Кох сообщил о возможном профилактическом и даже лечебном действии туберкулина, испытанного в опытах на морских свинках и применённого на себе и своей сотруднице (которая впоследствии стала его женой). Через год в Берлине было сделано официальное заключение о высокой эффективности туберкулина в диагностике, однако лечебные свойства туберкулина были названы противоречивыми, поскольку резко обострялось течение болезни.
В 1902 году в Берлине проведена первая Международная конференция по туберкулёзу.
В 1904 году Алексей Абрикосов опубликовал работы, в которых описал картину очаговых изменений в лёгких на рентгенограмме при начальных проявлениях туберкулёза у взрослых (очаг Абрикосова).
В 1907 году австрийский педиатр Клеменс Пирке предложил накожную пробу с туберкулином для выявления людей, инфицированных микобактерией туберкулёза.
В 1910 году Шарль Манту (Франция) и Феликс Мендель (Германия) предложили внутрикожный метод введения туберкулина, который в диагностическом плане оказался чувствительнее накожного.
В 1912 году исследователь Антон Гон (Австро-Венгрия) описал обызвествлённый первичный туберкулёзный очаг (очаг Гона).
Роль сниженного иммунитета у трудящихся и у социально незащищённых слоёв населения была понята после открытия иммунитета И. И. Мечниковым, специально изучавшим противотуберкулёзный иммунитет, и Паулем Эрлихом.
В 1919 году микробиолог Альбер Кальметт и ветеринарный врач Камиль Герен (оба — Франция) создали вакцинный штамм микобактерии туберкулёза для противотуберкулёзной вакцинации людей. Штамм был назван «бациллы Кальметта — Герена» (Bacilles Calmette-Guerin, BCG). Впервые вакцина БЦЖ была введена новорождённому ребёнку в 1921 году.
В 1925 году Кальметт передал профессору Льву Тарасевичу штамм вакцины БЦЖ, которая была названа БЦЖ-1. Через три года экспериментального и клинического изучения было установлено, что вакцина относительно безвредна. Смертность от туберкулёза среди вакцинированных детей в окружении бактерионосителей была меньше, чем среди невакцинированных. В 1928 году было рекомендовано вакцинировать БЦЖ новорождённых из очагов туберкулёзной инфекции. С 1935 года вакцинацию стали проводить в широких масштабах не только в городах, но и в сельской местности. В середине 1950-х годах вакцинация новорождённых стала обязательной. До 1962 года проводили в основном пероральную вакцинацию новорождённых, с 1962 года для вакцинации и ревакцинации стали применять более эффективный внутрикожный метод введения вакцины. В 1985 году для вакцинации новорождённых с отягощённым постнатальным периодом была предложена вакцина БЦЖ-М, которая позволяет уменьшить антигенную нагрузку вакцинируемых.
В 1930-е годы бразильский учёный Абреу предложил массовую флюорографию для выявления туберкулёза (кстати, сами выявляющиеся при флюорографии изменения были обнаружены русским учёным Алексеем Абрикосовым в 1904 году).
С середины 1930-х годов применяется эктомия поражённой туберкулёзом части лёгкого.
В 1943 году Зельман Ваксман совместно с Альбертом Шацем получил стрептомицин — первый противомикробный препарат, который оказывал бактериостатическое действие на микобактерии туберкулёза. В первые несколько лет применения стрептомицин обладал крайне высокой противотуберкулёзной активностью: даже смыв с флакона, где до этого находился лиофизат препарата, давал клинический эффект. Но всего через 10 лет эффективность препарата существенно снизилась, а в настоящее время его клинический эффект минимален. К концу XX века спектр антибактериальных препаратов, применяемых во фтизиатрии, значительно расширился.
Ежегодно 24 марта по инициативе Всемирной организации здравоохранения (ВОЗ) отмечается Всемирный день борьбы с туберкулёзом[22].
По данным ВОЗ, в 2024 году смертность от туберкулеза снизилась на 3 % и составила 1,23 миллиона человек[23].
Эпидемиология
Существует мнение, что M. tuberculosis инфицирована примерно треть населения Земли[24], и примерно каждую секунду возникает новый случай инфекции[25]. Распространение туберкулёза неравномерно по всему миру, около 80 % населения во многих азиатских и африканских странах имеют положительный результат туберкулиновых проб. В США, по данным на 2006 год, у 5—10 % населения такой тест положителен[3].
Благодаря эффективным мерам, предпринятым правительством и органами здравоохранения РФ, эпидемическая ситуация по туберкулёзу в 1990-е годы прошлого века заметно улучшилась: по данным Росстата, заболеваемость снизилась на 46,6 % (с 90,4 на 100 000 населения в 2000 году, до 38,3 — в 2017 году)[26],
Доля людей, которые заболевают туберкулёзом каждый год во всем мире, не изменяется или снижается, однако из-за роста численности населения абсолютное число новых случаев продолжает расти[25]. В 2007 году насчитывалось 13,7 миллиона зарегистрированных случаев хронического активного туберкулёза, 9,3 миллиона новых случаев заболевания и 1,8 миллиона случаев смерти, главным образом в развивающихся странах[27]. Кроме того, всё больше людей в развитых странах заболевают туберкулёзом, потому что их иммунная система ослабевает из-за приёма иммуносупрессивных препаратов или воздействия ВИЧ-инфекции.
Согласно докладу Всемирной Организации по здравоохранению (ВОЗ) в 2015 году насчитывалось 10,4 миллиона новых случаев заболевания туберкулёзом во всем мире, из которых 5,9 млн (56 %) было отмечено среди мужчин, 3,5 миллиона (34 %) среди женщин и 1,0 млн (10 %) среди детей. Люди, имеющие ВИЧ, составляли 1,2 млн (11 %) всех новых случаев заболевания туберкулёзом[28].
По данным ВОЗ, в 2015 году было зафиксировано 1,4 млн случаев смерти от туберкулёза, среди которых 0,4 млн человек имели ВИЧ[28].
В 2018 году смертность от туберкулёза составила (по странам, приведены государства с наибольшим числом умерших от туберкулёза)[29]:
- Индия — 449 тыс. чел.;
- Нигерия — 157 тыс. чел.;
- Индонезия — 98 тыс. чел;
- ЮАР — 64 тыс. чел.;
- Демократическая Республика Конго — 53 тыс. чел.;
- Бангладеш — 47 тыс. чел.;
- Пакистан — 44 тыс. чел.;
- Мозамбик — 43 тыс. чел.;
- Китай — 40 тыс. чел.;
- Танзания — 39 тыс. чел.
По заболеваемости туберкулёзом на 100 тысяч человек в 2018 году лидировали (более 50 случаев на 100 тыс. человек населения) в мире следующие страны (по данным ВОЗ, указано количество случаев на 100 тысяч жителей)[29]:
- ЦАР — 540;
- ЮАР — 520;
- КНДР — 513;
- Папуа-Новая Гвинея — 432;
- Монголия — 428;
- Демократическая Республика Конго — 321;
- Индонезия — 316;
- Либерия — 308;
- Пакистан — 265;
- Мадагаскар — 233;
- Нигерия — 219;
- Индия — 199;
- Афганистан — 189;
- Чад — 142;
- Боливия — 108.
Отмечено, что заболеваемость туберкулёзом зависит от неблагоприятных условий (стрессовой нагрузки), а также от индивидуальных характеристик организма человека (например, от группы крови и возраста заболевшего). Из числа заболевших в целом доминирует возрастная группа 18—26 лет[30].
Однако, несмотря на этот факт, в странах, где заболеваемость туберкулёзом значительно снизилась — таких, как Америка — доминировать среди заболевших стала статистическая группа пожилых людей[31].
Существует несколько факторов, вызывающих повышенную вероятность перехода туберкулёза в активную форму:
Основным источником инфицирования туберкулёзом являются носители с открытыми формами туберкулёза, то есть те, кто выделяет бациллы Коха во внешнюю среду[33]. Mycobacterium tuberculosis передаётся воздушно-капельным путём при разговоре, кашле и чихании больного[4].
Исследования начала двадцатого века показали, что заболеваемость туберкулёзом медицинского персонала противотуберкулёзных учреждений в 5—10 раз выше заболеваемости их коллег с другой специализацией. В этих же исследованиях отмечается, что медицинские работники часто занимаются самолечением или получают медицинскую помощь по месту работы, что значительно снижает статистические показатели и данные об их заболеваемости ниже истинных[34]. По данным директора ГУ НИИ медицины труда РАМН академика РАМН Н. Ф. Измерова (2005) и директора ЦНИИ эпидемиологии Роспотребнадзора академика РАМН Покровского, в наше время положение с охраной здоровья медицинских работников существенно не изменилось, наметилась тенденция к росту несчастных случаев и профессиональных заболеваний[34].
Этиология
Возбудителями туберкулёза являются микобактерии — кислотоустойчивые бактерии рода Mycobacterium. Всего известно 74 вида микобактерий. Они широко распространены в почве, воде, среди людей и животных. Однако туберкулёз у человека вызывает условно выделенный комплекс, включающий в себя Mycobacterium tuberculosis (человеческий вид), Mycobacterium bovis (бычий вид), Mycobacterium africanum, Mycobacterium bovis BCG (БЦЖ-штамм бычьего вида), Mycobacterium microti, Mycobacterium canettii. В последнее время к нему отнесены Mycobacterium pinnipedii, Mycobacterium caprae, филогенетически имеющие отношение к Mycobacterium microti и Mycobacterium bovis.
Туберкулёз, вызванный различными видами микобактерий, достаточно сильно различается между собой. Основной видовой признак микобактерии туберкулёза (МБТ) — патогенность, которая проявляется в вирулентности. Вирулентность может существенно изменяться в зависимости от факторов внешней среды и по-разному проявляться в зависимости от состояния макроорганизма, который подвергается бактериальной агрессии.
При туберкулёзе существует так называемый «скрытый резервуар» — сохраняющаяся пожизненно в организме человека или животного эндогенная инфекция после первичного инфицирования микобактериями туберкулёза. Удалить попавшие однажды в организм бациллы Коха практически невозможно, а это таит в себе риск эндогенной реактивации туберкулёзного процесса на любом этапе жизни человека при ухудшении социальных условий. Этим же объясняется и несостоятельность ликвидации туберкулёза как распространённого заболевания в ближайшее время, так как инфицированность взрослого населения к 40 годам жизни пока достигает 70—80—90 % и более в различных странах СНГ. Всего в мире носителей бактерий и больных не менее двух миллиардов человек, то есть треть населения мира. Носительство увеличивается с возрастом, поэтому носителями являются примерно половина взрослого населения Земли. Каждый десятый из носителей микобактерий туберкулёза в течение жизни будет страдать от активной формы туберкулёза. Каждый больной активной формой туберкулёза выделяет в сутки с мокротой от 15 млн до 7 млрд бацилл Коха, которые распространяются в радиусе 1—6 м, и спасти от которых может только солнечный свет, обычно недоступный при квартальной застройке. Отключение отопления, характерное для квартальной застройки, не помогает, так как палочка Коха выдерживает замораживание до минус 269 °C. Она сохраняет жизнеспособность в высохшей мокроте на одежде до 3—4 месяцев, в молочных продуктах — до года, на книгах — до 6 месяцев. В среднем один больной с активной формой туберкулёза способен за год заразить 10—15 человек.
Патогенез и патологическая анатомия
В поражённых туберкулёзом органах (лёгкие, мочеполовая система, лимфатические узлы, кожа, кости, кишечник и др.) развивается специфическое «холодное» туберкулёзное воспаление, носящее преимущественно гранулёматозный характер и приводящее к образованию множественных бугорков со склонностью к распаду.
Большое значение имеет первичная локализация инфекционного очага. Различают следующие пути передачи туберкулёза:
- Воздушно-капельный. Туберкулёзные микобактерии попадают в воздух с капельками при кашле, разговоре и чихании больного активным туберкулёзом. При вдыхании эти капельки с микобактериями попадают в лёгкие здорового человека. Это самый распространённый путь заражения.
- Алиментарный. Проникновение происходит через пищеварительный тракт.
- Контактный. Описаны случаи заражения через конъюнктиву глаза маленьких детей и взрослых. При этом иногда обнаруживается острый конъюнктивит и воспаление слёзного мешочка. Заражение туберкулёзом через кожу встречается редко.
- Внутриутробное заражение туберкулёзом. Заражение происходит или при поражении туберкулёзом плаценты, или при инфицировании повреждённой плаценты во время родов больной туберкулёзом матерью. Такой путь заражения туберкулёзом встречается крайне редко.
Система дыхания защищена от проникновения микобактерий мукоцилиарным клиренсом (выделение бокаловидными клетками дыхательных путей слизи, которая склеивает поступившие микобактерии, и дальнейшая элиминация микобактерий с помощью волнообразных колебаний мерцательного эпителия). Нарушение мукоцилиарного клиренса при остром и хроническом воспалении верхних дыхательных путей, трахеи и крупных бронхов, а также под воздействием токсических веществ делает возможным проникновение микобактерий в бронхиолы и альвеолы, после чего вероятность инфицирования и заболевания туберкулёзом значительно увеличивается.
Возможность заражения алиментарным путём обусловлена состоянием стенки кишечника и его всасывающей функции.
Возбудители туберкулёза не выделяют какой-либо экзотоксин, который мог бы стимулировать фагоцитоз. Возможности фагоцитоза микобактерий на этом этапе ограничены, поэтому присутствие в тканях небольшого количества возбудителя проявляется не сразу. Микобактерии находятся вне клеток и размножаются медленно, и ткани некоторое время сохраняют нормальную структуру. Это состояние называется «латентный микробизм». Независимо от начальной локализации они с током лимфы попадают в регионарные лимфатические узлы, после чего лимфогенно распространяются по организму — происходит первичная (облигатная) микобактериемия. Микобактерии задерживаются в органах с наиболее развитым микроциркуляторным руслом (лёгкие, лимфатические узлы, корковый слой почек, эпифизы и метафизы трубчатых костей, ампуллярно-фимбриональные отделы маточных труб, увеальный тракт глаза). Поскольку возбудитель продолжает размножаться, а иммунитет ещё не сформировался, популяция возбудителя значительно увеличивается[35].
Тем не менее, в месте скопления большого числа микобактерий начинается фагоцитоз. Сначала возбудителей начинают фагоцитировать и разрушать полинуклеарные лейкоциты, однако безуспешно — все они гибнут, вступив в контакт с МБТ, из-за слабого бактерицидного потенциала.
Затем к фагоцитозу МБТ подключаются макрофаги. Однако МБТ синтезируют АТФ-положительные протоны, сульфаты и факторы вирулентности (корд-факторы), в результате чего нарушается функция лизосом макрофагов. Образование фаголизосомы становится невозможным, поэтому лизосомальные ферменты макрофагов не могут воздействовать на поглощённые микобактерии. МБТ располагаются внутриклеточно, продолжают расти, размножаться и всё больше повреждают клетку-хозяина. Макрофаг постепенно погибает, а микобактерии вновь попадают в межклеточное пространство. Этот процесс называется «незавершённым фагоцитозом».
В основе приобретённого клеточного иммунитета лежит эффективное взаимодействие макрофагов и лимфоцитов. Особое значение имеет контакт макрофагов с Т-хелперами (CD4+) и Т-супрессорами (CD8+). Макрофаги, поглотившие МБТ, экспрессируют на своей поверхности антигены микобактерий (в виде пептидов) и выделяют в межклеточное пространство интерлейкин-1 (ИЛ-1), который активирует Т-лимфоциты (CD4+). В свою очередь, Т-хелперы (CD4+) взаимодействуют с макрофагами и воспринимают информацию о генетической структуре возбудителя[36]. Сенсибилизированные Т-лимфоциты (CD4+ и CD8+) выделяют хемотоксины, гамма-интерферон и Интерлейкин-2 (ИЛ-2), которые активируют миграцию макрофагов в сторону расположения МБТ, повышают ферментативную и общую бактерицидную активность макрофагов. Активированные макрофаги интенсивно вырабатывают активные формы кислорода и пероксид водорода. Это так называемый кислородный взрыв; он воздействует на фагоцитируемый возбудитель туберкулёза. При одновременном воздействии L-аргинина и фактора некроза опухоли образуется оксид азота NO, который также обладает антимикробным эффектом. В результате всех этих процессов разрушительное действие МБТ на фаголизосомы ослабевает, и бактерии разрушаются лизосомальными ферментами. При адекватном иммунном ответе каждое последующее поколение макрофагов становится всё более иммунокомпетентным. Выделяемые макрофагами медиаторы активируют также B-лимфоциты, ответственные за синтез иммуноглобулинов, однако их накопление в крови на устойчивость организма к МБТ не влияет. Но выработка B-лимфоцитами опсонирующих антител, которые обволакивают микобактерии и способствуют их склеиванию, является полезной для дальнейшего фагоцитоза.
Повышение ферментативной активности макрофагов и выделение ими различных медиаторов может вести к появлению клеток гиперчувствительности замедленного типа (ГЗТ) к антигенам МБТ. Макрофаги трансформируются в эпителиоидные гигантские клетки Лангханса, которые участвуют в ограничении зоны воспаления. Образуется экссудативно-продуктивная и продуктивная туберкулёзная гранулёма, образование которой свидетельствует о хорошем иммунном ответе на инфекцию и о способности организма локализовать микобактериальную агрессию. На высоте гранулёматозной реакции в гранулёме находятся Т-лимфоциты (преобладают), B-лимфоциты, макрофаги (осуществляют фагоцитоз, выполняют аффекторную и эффекторную функции); макрофаги постепенно трансформируются в эпителиоидные клетки (осуществляют пиноцитоз, синтезируют гидролитические ферменты). В центре гранулёмы может появиться небольшой участок казеозного некроза, который формируется из тел макрофагов, погибших при контакте с МБТ.
Реакция ГЗТ появляется через 2—3 недели после инфицирования, а достаточно выраженный клеточный иммунитет формируется через 8 недель. После этого размножение микобактерий замедляется, общее их число уменьшается, специфическая воспалительная реакция затихает. Но полной ликвидации возбудителя из очага воспаления не происходит. Сохранившиеся МБТ локализуются внутриклеточно (L-формы) и предотвращают формирование фаголизосомы, поэтому недоступны для лизосомальных ферментов. Такой противотуберкулёзный иммунитет называется нестерильным. Оставшиеся в организме МБТ поддерживают популяцию сенсибилизированных Т-лимфоцитов и обеспечивают достаточный уровень иммунологической активности. Таким образом, человек может сохранять МБТ в своём организме длительное время и даже всю жизнь. При ослаблении иммунитета возникает угроза активизации сохранившейся популяции МБТ и заболевания туберкулёзом.
Приобретённый иммунитет к МБТ снижается при СПИДе, сахарном диабете, язвенной болезни, злоупотреблении алкоголем и длительном применении наркотиков, а также при голодании, стрессовых ситуациях, беременности, лечении гормонами или иммунодепрессантами.
В целом риск развития туберкулёза у впервые инфицированного человека составляет около 8 % в первые 2 года после заражения, постепенно снижаясь в последующие годы.
В случае недостаточной активации макрофагов фагоцитоз неэффективен, размножение МБТ макрофагами не контролируется и потому происходит в геометрической прогрессии. Фагоцитирующие клетки не справляются с объёмом работы и массово гибнут. При этом в межклеточное пространство поступает большое количество медиаторов и протеолитических ферментов, которые повреждают прилежащие ткани. Происходит своеобразное «разжижение» тканей, формируется особая питательная среда, способствующая росту и размножению внеклеточно расположенных МБТ[37].
Большая популяция МБТ нарушает баланс в иммунной защите: количество Т-супресоров (CD8+) растёт, иммунологическая активность Т-хелперов (CD4+) падает. Сначала резко усиливается, а затем ослабевает ГЗТ к антигенам МБТ. Воспалительная реакция приобретает распространённый характер. Повышается проницаемость сосудистой стенки, в ткани поступают белки плазмы, лейкоциты и моноциты. Формируются туберкулёзные гранулёмы, в которых преобладает казеозный некроз. Усиливается инфильтрация наружного слоя полинуклеарными лейкоцитами, макрофагами и лимфоидными клетками. Отдельные гранулёмы сливаются, общий объём туберкулёзного поражения увеличивается. Первичное инфицирование трансформируется в клинически выраженный туберкулёз.
Формы туберкулёза лёгких
Туберкулёз лёгких может принимать различные формы:
- первичный туберкулёзный комплекс (очаг туберкулёзной пневмонии + лимфангит, лимфаденит средостения)
- туберкулёзный бронхоаденит, изолированный лимфаденит внутригрудных лимфатических узлов.
Эта форма может развиваться как при первичном заражении, так и во вторичной фазе. Является мелкоочаговой гематогенной генерализацией туберкулёза в результате прорыва инфекции из очага в кровяное русло[38].
Является формой вторичного туберкулёза лёгких. В отличие от милиарного туберкулёза имеет преимущественно лимфогенный характер диссеминации, образуя перибронхиально «муфты». Ренгенологически данная форма описана синдромом «снежной бури».
Как правило является вторичным. Характеризуется наличием групп очагов размером от нескольких миллиметров до сантиметра, чаще в одном лёгком.
Эта форма является обострением очаговых изменений при вторичном туберкулёзе.
Туберкулома (лат. tuberculum — бугорок, -ωμα от ὄγκωμα — опухоль), или казеома лёгких — своеобразная форма туберкулёза лёгких, на рентгеновском снимке имеющая сходство с опухолью, отсюда и её название.
Казеозная пневмония является тяжёлой формой туберкулёза, она может развиваться как при первичном заражении, так и во вторичном туберкулёзе. Характеризуется быстрым казеозным некрозом сливающихся участков специфической пневмонии со склонностью к расплавлению и образованию каверн.
Развивается в тех случаях, когда прогрессирование других форм (первичный комплекс, очаговый, инфильтративный, гематогенный диссеминированный туберкулёз) приводит к формированию каверны, то есть стойкой полости распада лёгочной ткани.
«Лёгочная чахотка» — является конечным этапом прогрессирующего развития других форм туберкулёза лёгких. Характеризуется наличием каверны или каверн с выраженной фиброзной капсулой, фиброзными изменениями в лёгочной ткани и наличием полиморфных бронхогенных метастазов различной давности.
Туберкулёзные плевриты делят на сухие и экссудативные. По характеру плеврального выпота экссудативные плевриты могут быть серозными и гнойными.
Плеврит, как правило, является осложнением туберкулёза лёгких. Переход туберкулёзного процесса на плевру возможен контактным, лимфогенным и гематогенным путём[38].
Разрушение лёгкого туберкулёзной этиологии. Это конечный этап развития туберкулёза лёгких. Разрушенное лёгкое — это цирротический или кавернозно-цирротический процесс, возникший как следствие гипервентиляции лёгкого в сочетании с туберкулёзными и нетуберкулёзными воспалительными изменениями или в результате тотального поражения лёгкого туберкулёзом с вторичным фиброзом.
Туберкулёз плевры, туберкулёз гортани, трахеи встречаются редко.
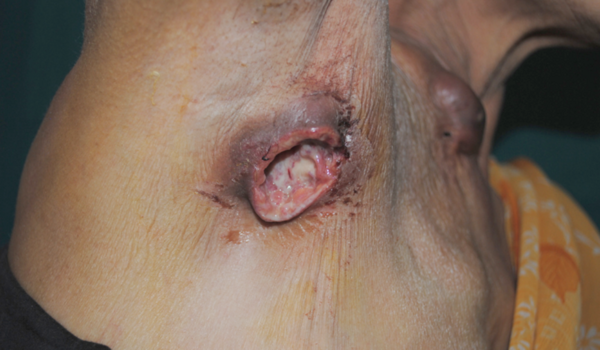
Внелёгочный туберкулёз может локализоваться в любом органе человека. Различают следующие формы внелёгочного туберкулёза:
- Туберкулёз органов пищеварительной системы — чаще всего поражаются дистальный отдел тонкой кишки и слепая кишка;
- Туберкулёз органов мочеполовой системы — поражение почек, мочевыводящих путей, половых органов;
- Туберкулёз центральной нервной системы и мозговых оболочек — поражение спинного и головного мозга, твёрдой оболочки головного мозга (туберкулёзный менингит);
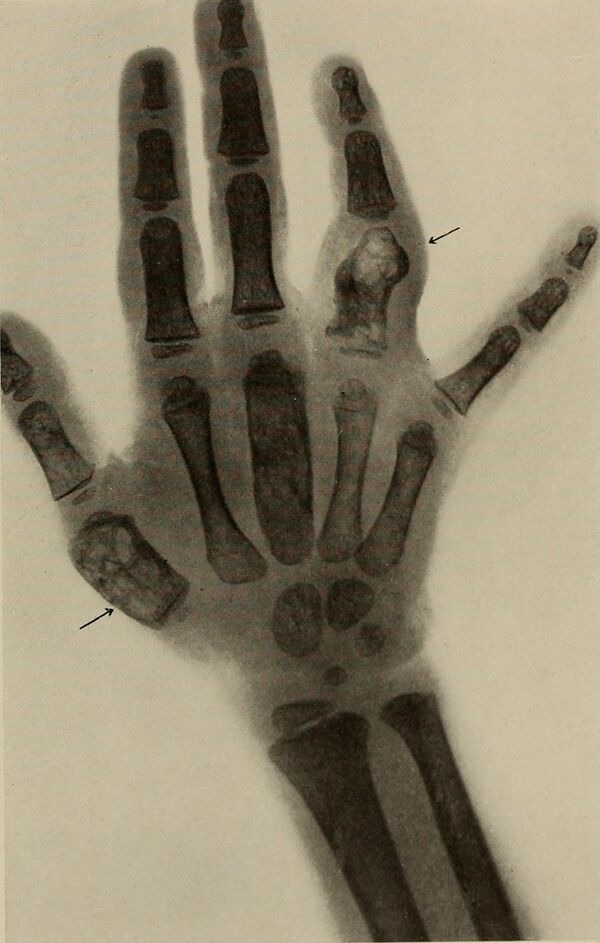
- Туберкулёз костей и суставов — чаще всего поражаются кости позвоночника (фунгозно-гнойное и грануляционно-гнойное воспаление только колена, вплоть до середины XIX века, классифицировалось отдельно и называлось «белая опухоль»; воспаление для других суставов не имело специального названия[39]);
- Туберкулёз кожи;
- Туберкулёз глаз.
Основные клинические проявления
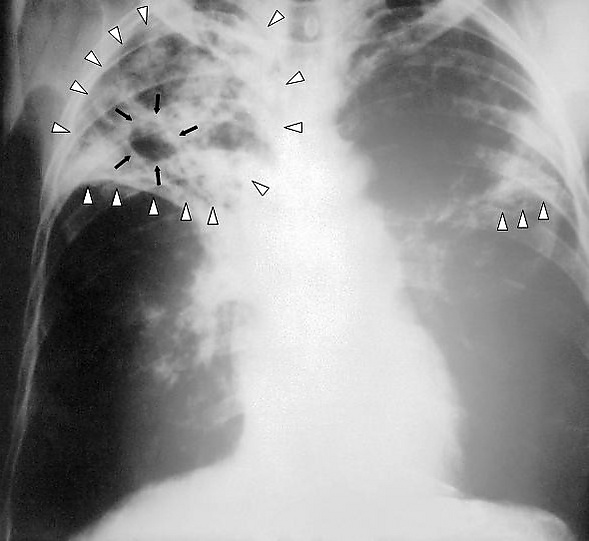
Туберкулёз лёгких может длительное время протекать бессимптомно или малосимптомно и обнаружиться случайно при проведении флюорографии или на рентгеновском снимке грудной клетки. Факт обсеменения организма туберкулёзными микобактериями и формирования специфической иммунологической гиперреактивности может быть также обнаружен при постановке туберкулиновых проб.
В случаях, когда туберкулёз проявляется клинически, обычно самыми первыми симптомами выступают неспецифические проявления интоксикации: слабость, бледность, повышенная утомляемость, вялость, апатия, субфебрильная температура (около 37 °C, редко выше 38°), потливость, особенно беспокоящая больного по ночам, похудение. Часто выявляется генерализованная или ограниченная какой-либо группой лимфатических узлов лимфаденопатия — увеличение размеров лимфатических узлов. Иногда при этом удаётся выявить специфическое поражение лимфатических узлов — «холодное» воспаление.
В крови больных туберкулёзом или обсеменённых туберкулёзной микобактерией при лабораторном исследовании часто обнаруживается анемия (снижение числа эритроцитов и содержания гемоглобина), умеренная лейкопения (снижение числа лейкоцитов). Некоторыми специалистами предполагается, что анемия и лейкопения при туберкулёзной инфекции — последствие воздействия токсинов микобактерий на костный мозг. Согласно другой точке зрения, всё обстоит строго наоборот — туберкулёзная микобактерия преимущественно «нападает» в основном на ослабленных лиц — не обязательно страдающих клинически выраженными иммунодефицитными состояниями, но, как правило, имеющих слегка пониженный иммунитет; не обязательно страдающих клинически выраженной анемией или лейкопенией, но имеющих эти параметры около нижней границы нормы и т. д. В такой трактовке анемия или лейкопения — не прямое следствие туберкулёзной инфекции, а, наоборот, предусловие её возникновения и предсуществовавший до болезни (преморбидный) фактор.
Далее по ходу развития заболевания присоединяются более или менее явные симптомы со стороны поражённого органа. При туберкулёзе лёгких это кашель, отхождение мокроты, хрипы в лёгких, насморк, иногда затруднение дыхания или боли в грудной клетке (указывающие обычно на присоединение туберкулёзного плеврита), кровохарканье. При туберкулёзе кишечника — те или иные нарушения функции кишечника, запоры, поносы, кровь в кале и т. д. Как правило (но не всегда), поражение лёгких бывает первичным, а другие органы поражаются вторично путём гематогенного обсеменения. Но встречаются случаи развития туберкулёза внутренних органов или туберкулёзного менингита без каких-либо текущих клинических или рентгенологических признаков поражения лёгких и без такового поражения в анамнезе.
Профилактика
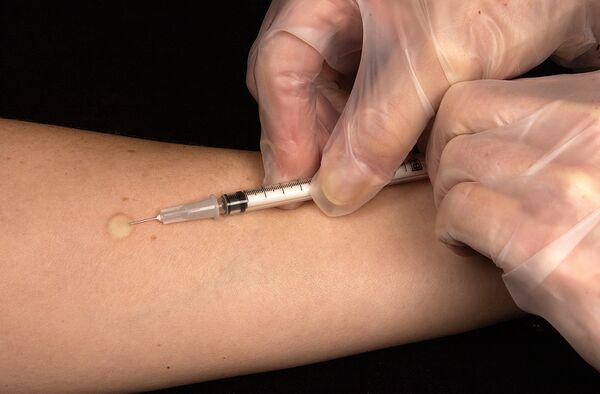
Основной профилактикой туберкулёза на сегодняшний день является вакцина БЦЖ (BCG). Она защищает от самой опасной формы туберкулёза — туберкулёзного менингита[40]. В соответствии с «Национальным календарём профилактических прививок» прививку делают в роддоме при отсутствии противопоказаний в первые 3—7 дней жизни ребёнка. В 7 лет при отрицательной реакции Манту и отсутствии противопоказаний проводят ревакцинацию.
В развитых странах вакцинация БЦЖ против туберкулёза предоставляется только тем, кто проживает или выезжает в эпидемически неблагополучные регионы. Высокий уровень заболеваемости туберкулёзом в отдельных регионах России не позволяет исключить вакцинацию против туберкулёза из российского национального календаря прививок[41].
По состоянию на 2022 год в России проводятся[42] клинические исследования III фазы противотуберкулёзной вакцины ГамТБвак, предназначенной для профилактики туберкулёза лёгких у взрослых[43].
С целью выявления туберкулёза на ранних стадиях всем взрослым необходимо проходить флюорографическое обследование в поликлинике не реже 1 раза в год (в зависимости от профессии, состояния здоровья и принадлежности к различным «группам риска»). Также при резком изменении реакции Манту по сравнению с предыдущей (т. н. «вираже»), фтизиатром может быть предложено провести профилактическую химиотерапию несколькими препаратами, как правило, в комплексе с гепатопротекторами и витаминами группы B[44]. У некоторых взрослых и примерно у 10 % детей, не прошедших курс профилактического лечения в период виража, развивается состояние, именуемое туберкулёзной интоксикацией.
Диагностика туберкулёза
Диагностика туберкулёза основана на флюорографии, рентгенографии и компьютерной томографии поражённых органов и систем, микробиологическом исследовании различного биологического материала, кожной туберкулиновой пробе (реакции Манту), а также методе молекулярно-генетического анализа (полимеразная цепная реакция) и др.
В 2023 году в России была изобретена новая тест-система на базе метода LAMP для выявления геномной ДНК M. tuberculosis, называемая ТБ-ИЗАТЕСТ[45]. Она требует на стадию амплификации не 40 минут, а всего 15 минут, позволяя проводить количественный анализ с пределом детекции 40 копий гена-мишени. В качестве мишени впервые для метода LAMP был использован ген lppQ (локус rv2341). Использование однокопийного гена позволяет проводить именно количественную диагностику, что позволяет оценивать бактериальную нагрузку образца[45].
Лечение туберкулёза
Лечение туберкулёза, особенно внелёгочных его форм, является сложным делом, требующим много времени и терпения, а также комплексного подхода.
Фактически с самого начала применения антибиотикотерапии возник феномен лекарственной устойчивости. Феномен обусловлен тем, что микобактерия не имеет плазмид, а популяционная устойчивость микроорганизмов к антибактериальным препаратам традиционно описывалась в микробной клетке наличием R-плазмид (от англ. resistance — устойчивость). Однако, несмотря на этот факт, отмечалось появление или исчезновение лекарственной устойчивости у одного штамма МБТ. В итоге выяснилось, что за активацию или дезактивацию генов, отвечающих за резистентность, ответственны IS-последовательности.
На сегодняшний день основой лечения туберкулёза является поликомпонентная противотуберкулёзная химиотерапия (J04 Противотуберкулёзные препараты).
Кроме химиотерапии, большое внимание должно уделяться интенсивному, качественному и разнообразному питанию больных туберкулёзом, набору массы тела при пониженной массе, коррекции гиповитаминозов, анемии, лейкопении (стимуляции эритро- и лейкопоэза). Больные туберкулёзом, страдающие алкоголизмом или наркотической зависимостью, должны пройти детоксикацию до начала противотуберкулёзной химиотерапии.
Больным туберкулёзом, получающим иммуносупрессивные препараты по каким-либо показаниям, стремятся снизить их дозы или совсем отменить их, уменьшив степень иммуносупрессии, если это позволяет клиническая ситуация по заболеванию, потребовавшему иммуносупрессивной терапии. Больным ВИЧ-инфекцией и туберкулёзом показана специфическая анти-ВИЧ терапия параллельно с противотуберкулёзной, а также противопоказано применение рифампицина[46].
Глюкокортикоиды в лечении туберкулёза применяют очень ограниченно в связи с их сильным иммуносупрессивным действием. Основными показаниями к назначению глюкокортикоидов являются сильное, острое воспаление, выраженная интоксикация и др. При этом глюкокортикоиды назначают на достаточно короткий срок, в минимальных дозах и только на фоне мощной (5-компонентной) химиотерапии.
Очень важную роль в лечении туберкулёза играет также санаторно-курортное лечение[47]. Давно известно, что микобактерии туберкулёза не любят хорошей оксигенации и предпочитают селиться в сравнительно плохо оксигенируемых верхушечных сегментах долей лёгких. Улучшение оксигенации лёгких, наблюдаемое при интенсификации дыхания в разрежённом воздухе горных курортов, способствует торможению роста и размножения микобактерий. С той же целью (создания состояния гипероксигенации в местах скопления микобактерий) иногда применяют гипербарическую оксигенацию и др.[48]
Сохраняют своё значение и хирургические методы лечения туберкулёза: в запущенных случаях может оказаться полезным наложение искусственного пневмоторакса и пневмоперитонеума, удаление поражённого лёгкого или его доли, дренирование каверны, эмпиемы плевры и др. Однако безусловным и важнейшим действенным средством является химиотерапия — терапия противотуберкулёзными препаратами, гарантирующими бактериостатический, бактериолитический эффекты, без которых невозможно достижение излечения от туберкулёза.
В 2016 году были опубликованы результаты исследований, в которых предлагаются новые потенциальные лекарства для лечения туберкулёза, механизм действия которых основан на селективной деактивации фермента лейцил-тРНК-синтетазы (ЛРСазы) возбудителя туберкулёза[49][50].
В 2018 году появилось независимое подтверждение тому, что открытие команды Университета Манчестера оказалось эффективным для морских свинок в Университете Рутгерса. Суть открытия состоит в модификации фактора вирулентности — MptpB, что делает микобактерии «видимыми» для иммунной системы. Это первый открытый метод лечения, не базирующийся на антибиотиках. Клетки человека не содержат подобных молекул, поэтому вещество полностью безопасно для пациентов. В ближайшие годы учёные планируют приступить к клиническим испытаниям на людях.
Прогноз
Прогноз заболевания во многом зависит от стадии, локализации заболевания, лекарственной устойчивости возбудителя и своевременности начала лечения, однако в целом является условно неблагоприятным[51]. Заболевание без усиленного диетического питания, благоприятных социально-гигиенических условий, климатолечения плохо поддаётся химиотерапии, особенно это касается туберкулёза с множественной лекарственной устойчивостью и широкой лекарственной устойчивостью, а хирургическое лечение зачастую является симптоматическим или паллиативным. Трудоспособность во многих случаях стойко утрачивается, и даже при сохранённой после излечения трудоспособности существует запрет на трудовую деятельность подобных лиц по целому ряду декретированных профессий, таких как учителя младших классов, воспитатели детских садов, сотрудники пищевой промышленности или коммунальных служб и т. п. Своевременно начатое лечение позволяет добиться полного восстановления трудоспособности, однако не гарантирует невозможность рецидива заболевания. При несвоевременной диагностике или неаккуратном лечении происходит инвалидизация пациента, зачастую в итоге приводящая к его смерти.
Примечания
Литература
- Внелёгочный туберкулёз : руководство для врачей / Под ред. Н. А. Браженко // СПб.: СпецЛит, 2013. — 395 с.; илл. — ISBN 978-5-299-00556-1
- Перельман М. И., Корякин В. А., Богадельникова И. В. Фтизиатрия : учебник / Изд. 3-е, перераб. и доп. // М.: Медицина, 2004. — 520 с.; илл. — ISBN 5-225-04082-9
- Сводное руководство ВОЗ по лечению лекарственно-устойчивого туберкулёза. — Женева : ВОЗ, 2019. — 116 с. — ISBN 978-92-890-5446-1.