Фтор
| 9 | Фтор
|
| 2s22p5 | |
Фто́р (химический символ — F, устар. «флюор»; от лат. Fluorum) — химический элемент 17-й группы (по устаревшей классификации — главной подгруппы седьмой группы, VIIA) второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 9.
Является самым химически активным неметаллом и сильнейшим окислителем. Фтор относится к группе галогенов и является самым лёгким элементом из этой группы.
Как простое вещество (при нормальных условиях) фтор — это двухатомный газ (формула — F2) бледно-жёлтого цвета с резким запахом, напоминающим озон или хлор. При криогенных температурах представляет собой жёлтую жидкость, бесцветный газ (в толстых слоях — зеленовато-жёлтый, н. у.).
Чрезвычайно токсичен. Обладает исключительно высокой коррозионной активностью.
Что важно знать
| Фтор | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ← Кислород | Неон → | |||||||||||||||
| |||||||||||||||
| Внешний вид простого вещества | |||||||||||||||
 Жидкий фтор |
|||||||||||||||
| Свойства атома | |||||||||||||||
| Название, символ, номер | Фтор/Fluorum (F), 9 | ||||||||||||||
| Группа, период, блок |
17 (устар. 7), 2, p-элемент |
||||||||||||||
| Атомная масса (молярная масса) |
18,998403163(6)[1] а. е. м. (г/моль) | ||||||||||||||
| Электронная конфигурация |
[He] 2s22p5 1s22s22p5 |
||||||||||||||
| Радиус атома | 73 пм | ||||||||||||||
| Химические свойства | |||||||||||||||
| Ковалентный радиус | 72 пм | ||||||||||||||
| Радиус иона | (−1e)133 пм | ||||||||||||||
| Электроотрицательность | 3,98 (шкала Полинга) | ||||||||||||||
| Электродный потенциал | 2,87 В | ||||||||||||||
| Степени окисления | −1, 0 | ||||||||||||||
| Энергия ионизации (первый электрон) |
1680,0 (17,41) кДж/моль (эВ) | ||||||||||||||
| Термодинамические свойства простого вещества | |||||||||||||||
| Плотность (при н. у.) |
Газ: 1,6960 г/л Жидкость.: 1,516−188 г/см3, Твёрдая фаза: 1,7−228 г/см3[2] или 1,810−225[3] г/см³ |
||||||||||||||
| Температура плавления | 53,53 К (−219,70 °C)[2] | ||||||||||||||
| Температура кипения | 85,03 К (−188,12 °C)[2] | ||||||||||||||
| Тройная точка | 53,48 К (−219,67°C), 90 кПа | ||||||||||||||
| Критическая точка | 144,4 К, 5,215 МПа | ||||||||||||||
| Уд. теплота плавления | (F—F) 0,5104 кДж/моль | ||||||||||||||
| Уд. теплота испарения | (F—F) 6,544 кДж/моль | ||||||||||||||
| Молярная теплоёмкость | 31,34[2] Дж/(K·моль) | ||||||||||||||
| Молярный объём | 22,4⋅103 см³/моль | ||||||||||||||
|
|||||||||||||||
| Кристаллическая решётка простого вещества | |||||||||||||||
| Структура решётки |
Моноклинная (α-фтор); Кубическая (β-фтор)[3] |
||||||||||||||
| Параметры решётки |
α-фтор: β = 102,088(18)°; a = 5,4780(12) Å; b = 3,2701(7) Å; c = 7,2651(17) Å[3]. β-фтор: a = 5,5314(15)[3] |
||||||||||||||
| Прочие характеристики | |||||||||||||||
| Номер CAS | 7782-41-4 | ||||||||||||||
История
Первое соединение фтора — флюорит (плавиковый шпат) CaF2 — описано в конце XV века под названием «флюор». В 1771 году Карл Шееле получил плавиковую кислоту. При обработке минерала флюорита CaF2 серной кислотой он выделил HF в виде водного раствора. Это событие рассматривается в истории химии как открытие фтора. Аналогию с хлором предложил в 1810 году Андре Ампер, его поддержал Гемфри Дэви. Дэви изучил растворения стекла в плавиковой кислоте.
Как химический элемент, входящий в состав плавиковой кислоты, фтор был предсказан в 1810 году, а выделен в свободном виде лишь 76 лет спустя Анри Муассаном в 1886 году электролизом жидкого безводного фтористого водорода, содержащего примесь кислого фторида калия KHF2.
Название «фтор» (от др.-греч. φθόριος 'разрушительный'), предложенное Андре Ампером в 1816 году[4], употребляется в русском, греческом и некоторых других языках. Во многих же других странах приняты названия, производные от старинных названий минерала флюорита CaF2, которые в свою очередь происходят от его способности понижать температуру плавления металлургического шлака, образующегося при восстановлении металлов из руд, и увеличивать его текучесть (лат. fluere 'течь'): например, тот же Ампер в письме Дэви от 26 августа 1812 предложил слово fluorine, благодаря адресату письма прочно вошедшее в английский язык.
Распространение в природе
Содержание фтора в атомных процентах в природе показано в таблице:
| Объект | Содержание, % |
|---|---|
| Почва | 0,02 |
| Воды рек | 0,00002 |
| Воды океана | 0,0001 |
| Зубы человека[5] | 0,01 |
В природе значительные скопления фтора содержатся, в основном, в минерале флюорите (CaF2), содержащем по массе 51,2 % Ca и 48,8 % F. Кларк в земной коре 650 г/т.
Из растений относительно богаты фтором чечевица и лук.
В почве фтор накапливается в результате вулканической деятельности, в составе вулканических газов обычно содержится большое количество фтороводорода.
Физические свойства
При нормальных условиях представляет собой бледно-жёлтый газ. В малых концентрациях в воздухе его запах напоминает одновременно озон и хлор. Очень агрессивен и сильно ядовит.
Фтор имеет аномально низкую температуру кипения (85,03 К, −188,12 °C) и плавления (53,53 К, −219,70 °C)[2]. Это связано с тем, что фтор не имеет d-подуровня и не способен образовывать полуторные связи, в отличие от остальных галогенов (кратность связи в остальных галогенах примерно 1,1)[6].
Ниже температуры плавления образует кристаллы бледно-жёлтого цвета[7][8].
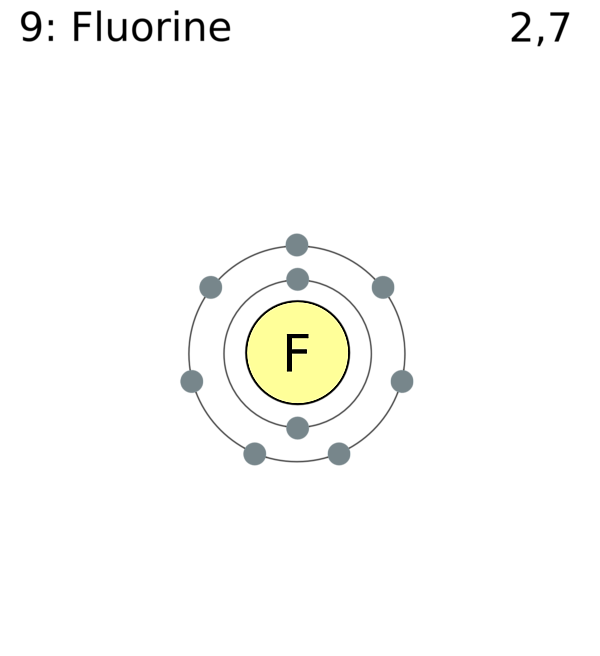
Электронная конфигурация атома фтора: 1s22s22p5.
Атомы фтора в соединениях могут проявлять степень окисления, равную −1. Положительные степени окисления в соединениях неизвестны, так как фтор является самым электроотрицательным элементом.
Квантовохимический терм атома фтора — 2P3/2.
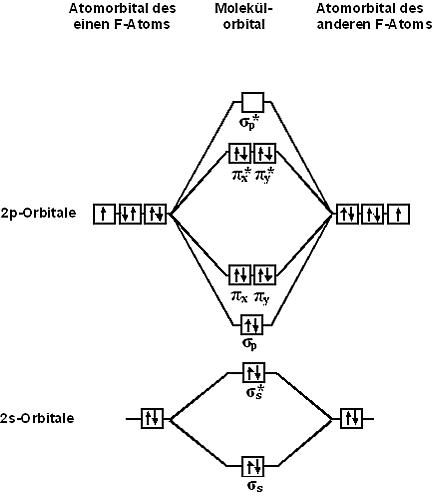
С точки зрения теории молекулярных орбиталей, строение двухатомной молекулы фтора можно охарактеризовать следующей диаграммой. В молекуле присутствует 4 связывающих орбитали и 3 разрыхляющих. Порядок связи в молекуле равен 1.
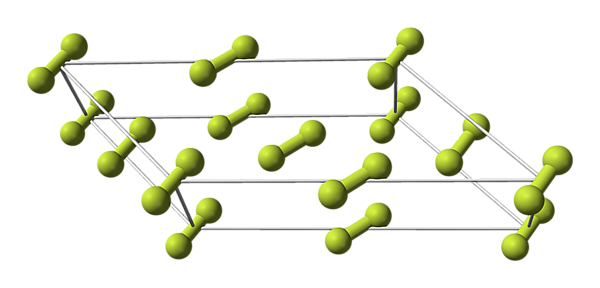
Фтор образует молекулярные кристаллы с двумя кристаллическими модификациями, стабильными при атмосферном давлении:
- α-фтор, непрозрачный, твёрдый и хрупкий[8], существует при температуре ниже 45,6 K, кристаллическая решётка моноклинной сингонии, пространственная группа C 2/c, параметры ячейки a = 0,54780(12) нм, b = 0,32701(7) нм, c = 0,72651(17) нм, β = 102,088(18)°, Z = 4, d = 1,98 г/см3 с объёмом элементарной ячейки 0,12726(5) нм3 (при 10 К)[2][3][8][9];
- β-фтор, прозрачный, менее плотный и твёрдый[8], существует в интервале температур от 45,6 К до точки плавления 53,53 K, кристаллическая решётка кубической сингонии (примитивная решётка), пространственная группа Pm3n, параметры ячейки a = 0,65314(15) нм, Z = 8, d = 1,81 г/см3 с объёмом элементарной ячейки 0,27862(11) нм3 (при 48 К), решётка изотипична γ-фазе O2 и δ-фазе N2[2][3]. В раннем (но единственном проведённом до 2019 года) эксперименте по изучению структуры β-фтора рентгенографическая плотность кристалла была оценена как 1,70(5) г/см3[7][10], и эта плотность твёрдого фтора цитируется в большинстве справочников. Более точное современное измерение даёт 1,8104(12) г/см3[3].
Фазовый переход между этими кристаллическими фазами фтора более экзотермичен, чем затвердевание жидкого фтора. Фаза ромбической сингонии у твёрдого фтора не обнаружена, в отличие от всех прочих галогенов. Молекулы α-фтора разупорядочены по направлению. Длина связи F—F в молекулах составляет 0,1404(12) нм[3].
Даже при столь низких температурах взаимодействие кристаллов фтора со многими веществами приводит к взрыву[8].
Фтор является моноизотопным элементом: в природе существует только один стабильный изотоп фтора 19F. Известны ещё 17 радиоактивных изотопов фтора с массовым числом от 14 до 31 и один ядерный изомер — 18mF. Самым долгоживущим из радиоактивных изотопов фтора является 18F с периодом полураспада 109,771 минуты, важный источник позитронов, использующийся в позитрон-эмиссионной томографии.
| Изотоп | Относительная масса, а. е. м. | Период полураспада | Тип распада | Ядерный спин | Ядерный магнитный момент |
|---|---|---|---|---|---|
| 17F | 17,0020952 | 64,5 c | β+-распад в 17O | 5/2 | 4,722 |
| 18F | 18,000938 | 1,83 часа | β+-распад в 18O | 1 | |
| 19F | 18,99840322 | Стабилен | — | 1/2 | 2,629 |
| 20F | 19,9999813 | 11 c | β−-распад в 20Ne | 2 | 2,094 |
| 21F | 20,999949 | 4,2 c | β−-распад в 21Ne | 5/2 | |
| 22F | 22,00300 | 4,23 c | β−-распад в 22Ne | 4 | |
| 23F | 23,00357 | 2,2 c | β−-распад в 23Ne | 5/2 |
Ядра изотопа 19F имеют полуцелый спин, поэтому возможно применение этих ядер для ЯМР-исследований молекул. Спектры ЯМР-19F являются достаточно характеристичными для фторорганических соединений.
Химические свойства
Самый активный неметалл, бурно взаимодействует почти со всеми веществами (кроме фторидов в высших степенях окисления и редких исключений — фторопластов) и с большинством из них — с горением и взрывом.
Образует соединения со всеми химическими элементами, кроме гелия и неона. Известно лишь два соединения с аргоном, существующих только при температуре ниже температуры кипения водорода, и только одно из них содержит фтор — гидрофторид аргона HArF[11].
К воздействию фтора при комнатной температуре устойчивы некоторые металлы за счёт образования на их поверхности плотной плёнки фторида, тормозящей реакцию со фтором, например, Al, Mg, Cu, Ni. Контакт фтора с водородом приводит к воспламенению и взрыву в кварцевых сосудах даже при очень низких температурах (до −252 °C), в магниевых сосудах для начала реакции нужен небольшой нагрев.
Не реагирует с гелием, неоном, аргоном, азотом, кислородом, тетрафторметаном. При комнатной температуре не реагирует с сухим сульфатом калия, углекислым газом и закисью азота. Без примеси фтороводорода при комнатной температуре не действует на стекло.
В атмосфере фтора горит даже вода и платина.
Фтор способен вытеснять другие галогены из своей группы из их солей:
- ,
- .
Реакция между щелочами и фтором:
- .
Продукты реакции фтора с водой, в зависимости от условий её протекания, могут различаться:
- ,
К реакциям, в которых фтор формально является восстановителем, относятся реакции разложения высших фторидов, например:
- ,
- .
Фтор также способен окислять в электрическом разряде кислород, образуя дифторид кислорода OF2 и диоксидифторид O2F2. Под давлением или при облучении ультрафиолетом реагирует с криптоном и ксеноном с образованием фторидов благородных газов.
Во всех соединениях фтор проявляет степень окисления −1. Чтобы фтор проявлял положительную степень окисления, требуется создание эксимерных молекул или иные экстремальные условия. Это требует искусственной ионизации атомов фтора[12].
Получение
Промышленный способ получения фтора включает добычу и обогащение флюоритовых руд, сернокислотное разложение их концентрата с образованием безводного HF и его электролитическое разложение.
Для лабораторного получения фтора используют разложение некоторых соединений, но все они не встречаются в природе в достаточном количестве, и их получают с помощью свободного фтора.
- В лабораторных условиях фтор можно получать с помощью показанной установки. В медный сосуд 1, заполненный расплавом KF·3HF, помещают медный сосуд 2, имеющий отверстия в дне. В сосуд 2 помещают толстый никелевый анод. Катод помещается в сосуд 1. Таким образом, в процессе электролиза газообразный фтор выделяется из трубки 3, а водород — из трубки 4. Важным требованием является обеспечение герметичности системы, для этого используют пробки из фторида кальция со смазкой из оксида свинца(II) и глицерина.
- В 1986 году, во время подготовки к конференции по поводу празднования 100-летия открытия фтора, Карл Кристе открыл способ чисто химического получения фтора с использованием реакции во фтороводородном растворе K2MnF6 и SbF5 при 150 °C[13]:
- Хотя этот метод не имеет практического применения, он демонстрирует, что электролиз необязателен; кроме того, все компоненты для данных реакций могут быть получены без использования газообразного фтора.
- Также для лабораторного получения фтора можно использовать нагрев фторида кобальта(III) до 300 °C, разложение фторидов серебра и некоторые другие способы.
Промышленное производство фтора осуществляется электролизом расплава кислого фторида калия KF·2HF (часто с добавлениями фторида лития), который образуется при насыщении расплава KF фтористым водородом до содержания 40—41 % HF. Процесс электролиза проводят при температурах около 100 °C в стальных электролизёрах со стальным катодом и угольным анодом.
Хранение
Фтор хранят в газообразном состоянии (под давлением) и в жидком виде (при охлаждении жидким азотом) в аппаратах из никеля и сплавов на его основе (монель-металл), из меди, алюминия и его сплавов, латуни, нержавеющей стали (это возможно, потому что эти металлы и сплавы покрываются плёнкой фторидов, которая защищает от дальнейшей реакции со фтором[14]).
Применение
Фтор используется для получения:
- фреонов — широко распространённых хладагентов;
- фторопластов — химически инертных и негорючих полимеров;
- фторкаучуков — химически инертных и негорючих эластомеров;
- элегаза SF6 — газообразного изолятора, применяемого в высоковольтной электротехнике;
- гексафторида урана UF6, применяемого для разделения изотопов урана в ядерной промышленности;
- гексафтороалюмината натрия — электролита для получения алюминия путём электролиза;
- фторидов металлов (например, W и V), которые обладают некоторыми полезными свойствами.
Фтор и некоторые его соединения являются сильными окислителями, поэтому могут применяться в качестве окислителя в ракетных топливах. Очень высокая эффективность фтора вызывала значительный интерес к нему и его соединениям. На заре космической эры в СССР и других странах существовали программы исследования фторсодержащих видов ракетного топлива. Однако продукты горения с фторсодержащими окислителями токсичны. Поэтому топлива на основе фтора не получили распространения в современной ракетной технике.
Фторированные углеводороды (например перфтордекалин) применяются в медицине как кровезаменители. Существует множество медицинских препаратов, содержащих фтор в структуре (фторотан, фторурацил, флуоксетин, галоперидол и др.). Фториды натрия, калия и др. в строго дозированных микроколичествах применяются для профилактики кариеса (см. ниже).
Биологическая и физиологическая роль
Фтор является жизненно необходимым для организма элементом[15][16]. Основным источником поступления фтора в организм человека является питьевая вода[17]. В организме человека преобладающая концентрация фтора содержится в эмали зубов в составе фторапатита — Ca5F(PO4)3 — и в костях. Общее содержание составляет 2,6 г, в том числе в костях 2,5 г[2]. Нормальное суточное поступление фтора в организм человека равно 2,5—3,5 мг[2]. При недостаточном (менее 0,5 мг/литр питьевой воды) или избыточном (более 1 мг/литр) потреблении фтора организмом могут развиваться заболевания зубов: кариес, пародонтоз, флюороз (крапчатость эмали) и остеосаркома. Также избыточное потребление фтора может приводить к поражениям костной системы[18][19].
Малое содержание фтора разрушает эмаль за счёт вымывания фтора из фторапатита с образованием гидроксоапатита, и наоборот.
Для профилактики кариеса рекомендуется использовать зубные пасты с добавками фторидов (натрия и/или олова), употреблять фторированную воду (до концентрации 1 мг/л) или применять местные аппликации 1—2 % раствором фторида натрия или фторида олова. Такие действия могут сократить вероятность появления кариеса на 30—50 %[20].
Предельно допустимая концентрация связанного фтора (в виде фторидов и фторорганических соединений) в воздухе промышленных помещений равна 0,0005 мг/литр воздуха.
Токсикология
Фтор представляет собой чрезвычайно агрессивное химическое вещество. Сильно ядовит, является сильным окислителем. Раздражающие свойства в несколько раз сильнее, чем у фтороводорода. Фтор — «судорожный яд», как и значительное число его соединений. Обладает кумулятивным действием. В организм проникает главным образом ингаляционным и пероральным путями. Характерные проявления интоксикации при ингаляционном воздействии сводятся к болезненности и жжению в области носа, глотки, за грудиной, кровотечению из носа, сухому кашлю. Возможен спазм гортани и бронхиальной мускулатуры. При осмотре обнаруживаются гиперемия, отёчность и некрозы слизистых оболочек носоглотки, изъязвления и даже прободения носовой перегородки. Слизистые дыхательных путей также некротизируются и покрываются жёлтыми корочками.
При лёгких ингаляционных отравлениях фтором и его соединениями, как правило, ограничиваются развитием ринофаринголарингита и трахеобронхита на фоне общей слабости, утомляемости, лабильности пульса и АД. — отравление «маскируется» под «простуду», что затрудняет своевременную диагностику и лечение.
При поражениях фтором и его соединениями средней тяжести диагностируются глубокие бронхиты, и, с задержкой, пневмонии; а также судороги и гепатиты.
В случае тяжёлых отравлений — развиваются поражение тканей и токсический отёк лёгких, коматозное состояние, судороги.
Резорбтивное действие объясняется возможностью фтора вступать в свободно-радикальные реакции с тканями организма — осаждение кальция из сыворотки крови и тканевой жидкости в форме фторида, приводящие к глубоким нарушениям в обмене веществ, замедлению свёртываемости крови, нарушению кислотно-основного соотношения крови, нарушению нервно-мышечной проводимости, увеличению проницаемости сосудистых стенок. Кроме того, фтор нарушает функционирование ряда ферментных систем, взаимодействуя с магнием, марганцем, железом, цинком, входящих, как и кальция, в состав энзимов, являясь их активаторами или ингибиторами. Отравления фтором нарушает активность ферментов, использующих микроэлементы в качестве кофакторов, например снижается активность Энолазы (нарушение гликолиза и синтеза макроэргов), аденозинтрифосфатазы, глутаминсинтетазы.
Ожоги глаз и кожных покровов наблюдаются при непосредственном контакте с фтором. Контакт кожи с газом в течение 2 секунд вызывает термический ожог II степени; воздействие в концентрации 0,15-0,30 мг/л приводит к раздражению открытых участков кожи. При обследовании 252 человек, подвергающихся воздействию фтора, у 57 обнаружены конъюнктивиты или экзема век[21].
Фтор депонируется в костях и медленно, в течение нескольких лет, выводится из организма почками и кишечником.
Примечания
Литература
- Рысс И. Г. Химия фтора и его неорганических соединений. М. Госхимиздат, 1966 г. — 718 с.
- Некрасов Б. В. Основы общей химии. (издание третье, том 1) М. Химия, 1973 г. — 656 с.
- Военная Токсикология, Радиология и Медицинская Защита. Учебник. ВМА им. С. М. Кирова. Ленинград, 1987 г. — 356с.
Ссылки
- Информация о Перфторане
- Кровезаменитель Перфторан // Вестник РАН, 1997, том 67, N 11, с. 998—1013.