Бор (элемент)
| 5 | Бор
|
| 2s22p1 | |
Бор (химический символ — B, от лат. Borum) — химический элемент 13-й группы (по устаревшей классификации — главной подгруппы третьей группы, IIIA) второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 5.
Простое вещество бор — это бесцветный, серый или красный кристаллический, либо тёмный аморфный полуметалл. Известно более 10 аллотропных модификаций бора, образование и взаимные переходы которых определяются температурой, при которой бор был получен[4].
Что важно знать
| Бор | ||||
|---|---|---|---|---|
| ← Бериллий | Углерод → | ||||
| ||||
| Внешний вид простого вещества | ||||
 Элементарный бор (смесь аллотропных форм) |
||||
| Свойства атома | ||||
| Название, символ, номер | Бор / Borum (B), 5 | |||
| Группа, период, блок |
13 (устар. 3), 2, p-элемент |
|||
| Атомная масса (молярная масса) |
[10,806; 10,821][комм 1][1] а. е. м. (г/моль) | |||
| Электронная конфигурация |
[He] 2s22p1 1s22s22p1 |
|||
| Радиус атома | 98 пм | |||
| Химические свойства | ||||
| Ковалентный радиус | 82 пм | |||
| Радиус иона | 23 (+3e) пм | |||
| Электроотрицательность | 2,04 (шкала Полинга) | |||
| Степени окисления | -3, 0, +3 | |||
| Энергия ионизации (первый электрон) |
800,2(8,29) кДж/моль (эВ) | |||
| Термодинамические свойства простого вещества | ||||
| Плотность (при н. у.) | 2,34 г/см³ | |||
| Температура плавления | 2 348 K[2][3] (2075 °C) | |||
| Температура кипения | 4 138 K[2] (3865 °C) | |||
| Уд. теплота плавления | 23,60 кДж/моль | |||
| Уд. теплота испарения | 504,5 кДж/моль | |||
| Молярная теплоёмкость | 11,09[4] Дж/(K·моль) | |||
| Молярный объём | 4,6 см³/моль | |||
| Кристаллическая решётка простого вещества | ||||
| Структура решётки | Ромбоэдрическая | |||
| Параметры решётки | a=10,17; α=65,18 Å | |||
| Отношение c/a | 0,576 | |||
| Температура Дебая | 1250 (976,85°C; 1790,33°F) K | |||
| Прочие характеристики | ||||
| Теплопроводность | (300 K) 27,4 Вт/(м·К) | |||
| Номер CAS | 7440-42-8 | |||
История и происхождение названия
Впервые получен в 1808 году французскими химиками Ж. Гей-Люссаком и Л. Тенаром нагреванием борного ангидрида B2O3 с металлическим калием. Через несколько месяцев бор получил Гемфри Дэви электролизом расплавленного B2O3.
Название элемента произошло от арабского слова бу́рак (араб. بورق) или персидского бурах (перс. بوره)[5], которые использовались для обозначения буры[6].
Нахождение в природе
Среднее содержание бора в земной коре составляет 4 г/т. Несмотря на это, известно около 100 собственных минералов бора; он почти не встречается в качестве примеси в других минералах. Это объясняется, прежде всего, тем, что у комплексных анионов бора (а именно в таком виде он входит в большинство минералов) нет достаточно распространённых аналогов. Почти во всех минералах бор связан с кислородом, а группа фторсодержащих соединений совсем малочисленна. Элементарный бор в природе не встречается. Он входит во многие соединения и широко распространён, особенно в небольших концентрациях; в виде боросиликатов и боратов, а также в виде изоморфной примеси в минералах входит в состав многих изверженных и осадочных пород. Бор известен в нефтяных и морских водах (в морской воде 4,6 мг/л[7]), в водах соляных озёр, горячих источников и грязевых вулканов.
Общемировые разведанные запасы бора составляют около 1,3 млн тонн[8].
Основные минеральные формы бора:
- боросиликаты: датолит CaBSiO4OH, данбурит CaB2Si2O8;
- бораты: бура Na2B4O7·10H2O, ашарит MgBO2(OH), гидроборацит (Ca, Mg)B6O11·6H2O, иниоит Ca2B6O11·13H2O, калиборит KMg2B11O19·9H2O.
Также различают несколько типов месторождений бора:
- месторождения боратов в магнезиальных скарнах:
- людвигитовые и людвигито-магнетитовые руды;
- котоитовые руды в доломитовых мраморах и кальцифирах;
- ашаритовые и ашарито-магнетитовые руды;
- месторождения боросиликатов в известковых скарнах (датолитовые и данбуритовые руды);
- месторождения боросиликатов в грейзенах, вторичных кварцитах и гидротермальных жилах (турмалиновые концентрации);
- вулканогенно-осадочные:
- борные руды, отложенные из продуктов вулканической деятельности;
- переотложенные боратовые руды в озёрных осадках;
- погребённые осадочные боратовые руды;
- галогенно-осадочные месторождения:
- месторождения боратов в галогенных осадках;
- месторождения боратов в гипсовой шляпе над соляными куполами.
Основные запасы боратов в мире находятся в Турции и США, при этом на Турцию приходится более 70%. Крупнейшим производителем борсодержащей продукции в мире является турецкая компания Eti Mine Works[9][10].
Крупнейшее месторождение боратов России находится в Дальнегорске (Приморье). Его разработку осуществляет «Горно-химическая компания «Бор»», которая занимает третье место в мире по производству борсодержащей продукции, уступая лишь Eti Mine Works и Rio Tinto Group[9].
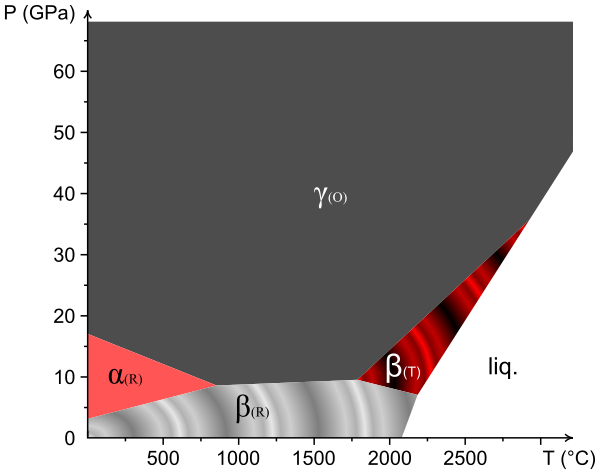
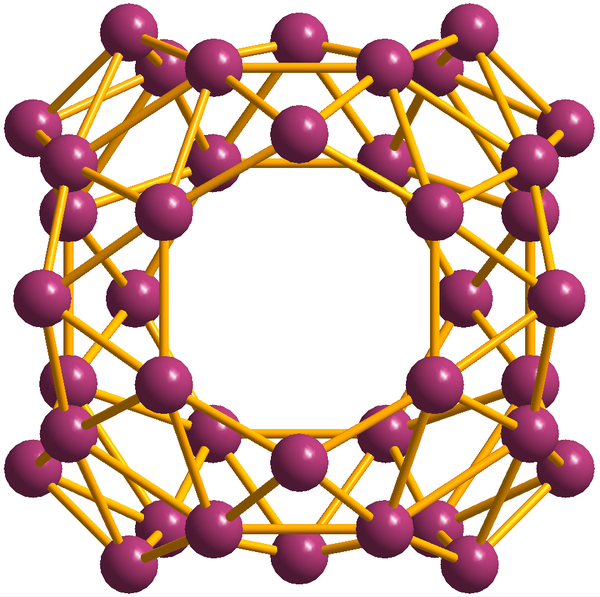
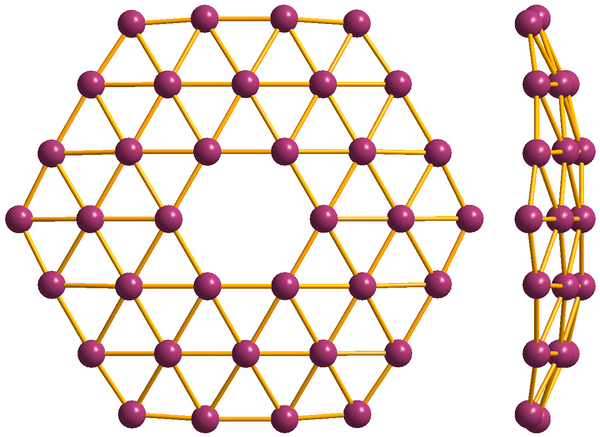
Аллотропные модификации
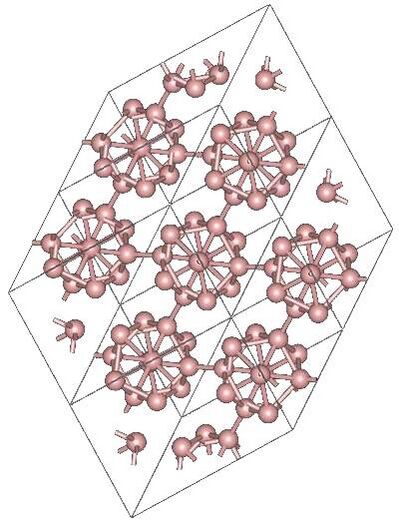
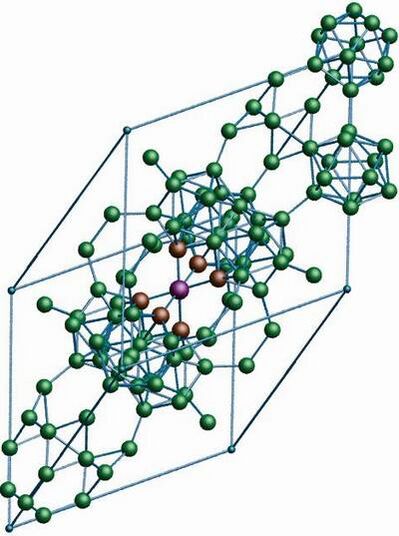
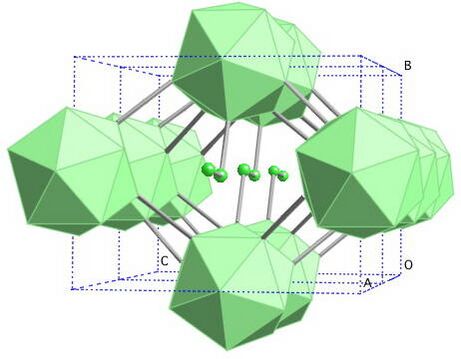
Бор похож на углерод по своей способности образовывать стабильные ковалентно связанные молекулярные сетки. Даже неупорядоченный (аморфный) бор содержит икосаэдрические мотивы B12 кристаллического бора, которые связаны друг с другом без образования дальнего порядка[11][12]. Кристаллический бор — очень твёрдый чёрный материал с температурой плавления выше 2000 °C. Он образует четыре основные полиморфные формы: α-ромбоэдрический и β-ромбоэдрический (α-R и β-R), γ и β-тетрагональный (β-T); также существует α-тетрагональная фаза (α-T), но её очень трудно получить в чистом виде. Большинство фаз основаны на икосаэдрических мотивах B12, но γ-фазу можно описать как фазу типа NaCl c чередующимся расположением икосаэдров и атомных пар B2[13]. γ-фазу можно получить путем сжатия других фаз бора до 12—20 ГПа и нагревания до 1500—1800 °C; она остаётся стабильной после понижения температуры и давления. Т-фаза образуется при аналогичных давлениях, но при более высоких температурах (1800—2200 °C). Что касается α и β фаз, то они могут сосуществовать при условиях окружающей среды, причем β-фаза является более стабильной[13][14][15]. При сжатии бора выше 160 ГПа образуется фаза бора с неизвестной структурой, которая является сверхпроводящей при температуре 6—12 К[16].
| Фаза | α-R | β-R | γ | β-T |
|---|---|---|---|---|
| Симметрия | ромбоэдрическая | ромбоэдрическая | орторомбическая | тетрагональная |
| Количество атомов в элементарной ячейке[13] | 12 | ~105 | 28 | |
| Плотность (г/см3)[17][18][19][20] | 2,46 | 2,35 | 2,52 | 2,36 |
| Твёрдость по Виккерсу (ГПа)[21][22] | 42 | 45 | 50—58 | |
| Модуль Юнга (ГПа)[22][23] | 185 | 224 | 227 | |
| Ширина запрещённой зоны (эВ)[22][24] | 2 | 1,6 | 2,1 |
Экспериментально обнаружены и описаны боросферены (фуллерено-подобные молекулы B40))[27] и борофены (графено-подобные структуры)[28][29].
Физические свойства
Чрезвычайно твёрдое (уступает только алмазу, нитриду бора (боразону), карбиду бора, сплаву бор-углерод-кремний, карбиду скандия-титана) и хрупкое вещество. Широкозонный полупроводник, диамагнетик, плохой проводник тепла.
У бора самый высокий предел прочности на разрыв — 5,7 ГПа.
В кристаллической форме имеет серовато-чёрный цвет (очень чистый бор бесцветен).
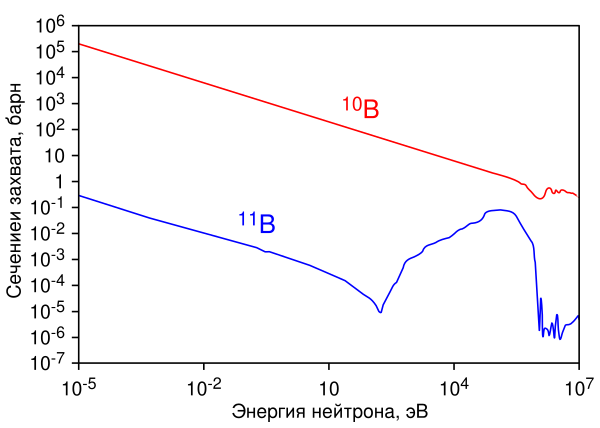
В природе бор находится в виде двух изотопов 10В (19,8 %) и 11В (80,2 %)[30][31].
10В имеет очень высокое сечение захвата тепловых нейтронов, равное 3837 барн (для большинства нуклидов это сечение близко к единицам или долям барна), причём при захвате нейтрона образуются два нерадиоактивных ядра (альфа-частица и литий-7), очень быстро тормозящиеся в среде, а проникающая радиация (гамма-кванты) при этом отсутствует, в отличие от аналогичных реакций захвата нейтронов другими нуклидами:
Поэтому 10В в составе борной кислоты и других химических соединений применяется в атомных реакторах для регулирования реактивности, а также для биологической защиты от тепловых нейтронов. Кроме того, бор применяется в нейтрон-захватной терапии рака.
Кроме двух стабильных, известно ещё 12 радиоактивных изотопов бора, из них самым долгоживущим является 8В с периодом полураспада 0,77 с.
Происхождение
Все изотопы бора возникли в межзвёздном газе в результате расщепления тяжёлых ядер космическими лучами или при взрывах сверхновых.
Химические свойства
По многим физическим и химическим свойствам полуметалл бор напоминает кремний.
1) Ввиду своей химической инертности, бор (при комнатной температуре) взаимодействует только со фтором:
2) Взаимодействие с другими галогенами (при нагревании) приводит к образованию тригалогенидов, с азотом — нитрид бора (BN), с фосфором — фосфид бора (BP), с углеродом — карбиды различного состава (B4C, B12C3, B13C2). При нагревании в атмосфере кислорода или на воздухе бор сгорает с большим выделением теплоты с образованием оксида бора (B2O3):
3) Напрямую с водородом бор не взаимодействует, однако известно довольно большое число бороводородов (боранов) различного состава, получаемых при обработке боридов щелочных или щелочноземельных металлов кислотой:
4) Бор, при сильном нагревании, проявляет восстановительные свойства. Например, восстановление кремния или фосфора из их оксидов при взаимодействии с бором:
Данное свойство бора объясняется очень высокой прочностью химических связей в оксиде бора — B2O3.
5) Устойчив к действию растворов щелочей (при отсутствии окислителей). Растворяется в расплаве смеси гидроксида и нитрата калия:
6) Растворяется в горячей азотной, серной кислотах и в царской водке с образованием борной кислоты (H3BO3):
7) Взаимодействия оксида бора (типичного кислотного оксида) с водой с образованием борной кислоты:
8) При взаимодействии борной кислоты со щелочами возникают соли не самой борной кислоты — бораты (содержащие анион BO33−), а тетрабораты (содержащие анион B4O72−), например:
В 2014 г. исследователями из Германии был получен бис(диазаборолил) бериллия, в котором атомы бериллия и бора образуют двухцентровую двухэлектронную связь (2c-2e), впервые полученную и нехарактерную для соседних элементов в Периодической таблице[32][33].
Получение
1) Пиролиз бороводородов:
Данным способом образуется наиболее чистый бор, который в дальнейшем используется для производства полупроводниковых материалов и тонкого химического синтеза.
2) Метод металлотермии (чаще, происходит восстановление магнием или натрием):
3) Термическое разложение паров бромида бора на раскалённой (1000—1200 °C) вольфрамовой проволоке в присутствии водорода (метод Ван-Аркеля):
Применение
Бор (в виде волокон) служит упрочняющим веществом многих композиционных материалов.
Также бор часто используют в электронике в качестве акцепторной добавки для изменения типа проводимости кремния.
Бор применяется в металлургии в качестве микролегирующего элемента, значительно повышающего прокаливаемость сталей.
Бор применяется и в медицине при бор-нейтронозахватной терапии (способ избирательного поражения клеток злокачественных опухолей)[34].
Используется в производстве терморезисторов.
Карбид бора применяется в компактном виде для изготовления газодинамических подшипников.
Пербораты / пероксобораты (содержат ион [B2(O2)2(OH)4]2−) [B4O12H8]−) применяются как окислительные агенты. Технический продукт содержит до 10,4 % «активного кислорода», на их основе производят отбеливатели, не содержащие хлор («персиль», «персоль» и др.).
Отдельно также стоит указать на то, что сплавы бор-углерод-кремний обладают сверхвысокой твёрдостью и способны заменить любой шлифовальный материал (кроме алмаза, нитрида бора по микротвёрдости), а по стоимости и эффективности шлифования (экономической) превосходят все известные человечеству абразивные материалы.
Сплав бора с магнием (диборид магния MgB2) обладает, на данный момент[на какой момент?], рекордно высокой критической температурой перехода в сверхпроводящее состояние среди сверхпроводников первого рода[35]. Появление вышеуказанной статьи стимулировало большой рост работ по этой тематике[36].
Борная кислота (B(OH)3) широко применяется в атомной энергетике в качестве поглотителя нейтронов в ядерных реакторах типа ВВЭР (PWR) на «тепловых» («медленных») нейтронах. Благодаря своим нейтронно-физическим характеристикам и возможности растворяться в воде применение борной кислоты делает возможным плавное (не ступенчатое) регулирование мощности ядерного реактора путём изменения её концентрации в теплоносителе — так называемое «борное регулирование».
Борная кислота применяется также в медицине и ветеринарии.
Нитрид бора, активированный углеродом, является люминофором со свечением от синего до жёлтого цвета под действием ультрафиолета. Обладает самостоятельной фосфоресценцией в темноте и активируется органическими веществами при нагреве до 1000 °С. Изготовление люминофоров из нитрида бора состава BN/C не имеет промышленного назначения, но широко практиковалось химиками-любителями в первой половине XX века.
Боросиликатное стекло — стекло обычного состава, в котором заменяют щелочные компоненты в исходном сырье на окись бора (B2O3).
Фторид бора BF3 при нормальных условиях является газообразным веществом, используется как катализатор в оргсинтезе, а также как рабочее тело в газонаполненных детекторах тепловых нейтронов благодаря захвату нейтронов бором-10 с образованием ядер лития-7 и гелия-4, ионизирующих газ (см. реакцию выше).
Ряд производных бора (бороводороды) являются эффективными ракетными топливами (диборан B2H6, пентаборан, тетраборан и др.), а некоторые полимерные соединения бора с водородом и углеродом стойки к химическим воздействиям и высоким температурам (как широко известный пластик Карборан-22).
Нитрид бора (боразон) подобен (по составу электронов) углероду. На его основе образуется обширная группа соединений, в чём-то подобных органическим.
Так, гексагидрид боразона (H3BNH3, похож на этан по строению) при обычных условиях твёрдое соединение с плотностью 0,78 г/см3, содержит почти 20 % водорода по массе. Его могут использовать водородные топливные элементы, питающие электромобили[37].
Биологическая роль
Бор — важный микроэлемент, необходимый для нормальной жизнедеятельности растений. Недостаток бора останавливает их развитие, вызывает у культурных растений различные болезни. В основе этого лежат нарушения окислительных и энергетических процессов в тканях, снижение биосинтеза необходимых веществ. При дефиците бора в почве в сельском хозяйстве применяют борные микроудобрения (борная кислота, бура и другие), повышающие урожай, улучшающие качество продукции и предотвращающие ряд заболеваний растений.[источник не указан 4355 дней]
Роль бора в животном организме не выяснена. В мышечной ткани человека содержится (0,33—1)⋅10−4 % бора, в костной ткани (1,1—3,3)⋅10−4 %, в крови — 0,13 мг/л[источник не указан 4355 дней]. Ежедневно с пищей человек получает 1—3 мг бора[источник не указан 4355 дней]. Токсичная доза — 4 г[источник не указан 4355 дней]. ЛД₅₀ ≈ 6 г/кг массы тела[38].
Один из редких типов дистрофии роговицы связан с геном, кодирующим белок-транспортер, предположительно регулирующий внутриклеточную концентрацию бора[39].
Комментарии
- ↑ Указан диапазон значений атомной массы в связи с различной распространённостью изотопов в природе.
Примечания
Литература
- А. В. Скальный, И. А. Рудаков. Биоэлементы в медицине. — 2004.
- Львов М. Д. Бор, химический элемент // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
Ссылки
- Бор на Webelements Архивная копия от 30 августа 2004 на Wayback Machine
- Бор в Популярной библиотеке химических элементов Архивная копия от 7 ноября 2006 на Wayback Machine
- Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров. — 3-е изд. — М. : Советская энциклопедия, 1969—1978.















![{\displaystyle {\ce {2B + 2KOH + 3KNO3 ->[t] 2KBO2 + 3KNO2 + H2O}}}](https://ru.ruwiki.ru/api/rest_v1/media/math/render/svg/069c64adc251f1745a10874f4d9015e6e5a2692a)
![{\displaystyle {\ce {3HNO3 + B ->[t] H3BO3 + 3NO2 ^}}}](https://ru.ruwiki.ru/api/rest_v1/media/math/render/svg/1d1835197f2b556cbf1bb5f4722ba75fb4622d1e)


![{\displaystyle {\ce {B2H6 ->[t] 2B + 3H2}}}](https://ru.ruwiki.ru/api/rest_v1/media/math/render/svg/3d7629b4169c6e34744cecc82076178172f6333a)


![{\displaystyle {\ce {2BBr3 + 3H2 ->[W] 2B + 6HBr}}}](https://ru.ruwiki.ru/api/rest_v1/media/math/render/svg/f9a63b02571e11ad2f26d9f17ea87aaaa339ceb3)
