Тетрафторид углерода
Тетрафтормета́н (четырёхфтористый углерод, тетрафторид углерода, CF4) — бинарное химическое соединение. Коммерческие названия соединения при использовании в качестве хладагента: фреон-14, хладон-14[1].
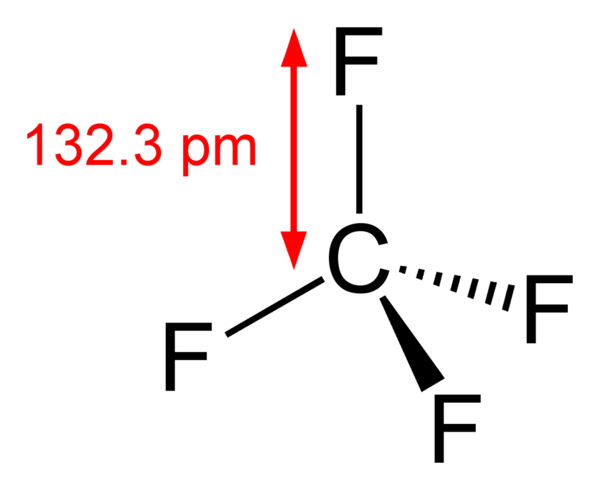
Тетрафторметан является самым простым из перфторуглеродов. По сравнению с другими тетрагалогенидами углерода обладает более высокой химической стойкостью. Из-за большого количества связей углерод-фтор и высокой электроотрицательности фтора атом углерода в этом соединении имеет значительный положительный заряд, что укрепляет и укорачивает связь углерод-фтор.
Практически нетоксичен.
Что важно знать
| Тетрафторид углерода | |
|---|---|
| Общие | |
| Систематическое наименование |
фторид углерода(IV), тетрафторид углерода |
| Сокращения | R14 |
| Традиционные названия | тетрафторметан, тетрафторуглерод, перфторметан, "метфоран", углерод четырехфтористый, углерода тетрафторид, фреон 14, хладон 14 |
| Хим. формула | CF4 |
| Физические свойства | |
| Состояние | бесцветный газ без запаха |
| Молярная масса | 88,0043 г/моль |
| Плотность |
газ 3,72 г/л; жидкость 1,96 кг/л при -184 °C |
| Термические свойства | |
| Температура | |
| • плавления | −183,6 °C |
| • кипения | −127,8 °C |
| Критическая точка |
температура: −45,65 °C давление: 3,745 МПа плотность: 0,625 г/см³ |
| Энтальпия | |
| • образования | −933 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 0,005 % при 20 °C |
| • в остальных веществах | смешивается с этанолом, эфиром, бензолом |
| Оптические свойства | |
| Показатель преломления | 1,113 |
| Структура | |
| Дипольный момент | 0,461 Д |
| Классификация | |
| Рег. номер CAS | 75-73-0 |
| 3D model (JSmol) | Интерактивная схема |
| PubChem | 6393 |
| UNII | 94WG9QG0JN |
| CompTox Dashboard EPA | DTXSID2041757 |
| Рег. номер EINECS | 200-896-5 |
| SMILES | |
| InChI | |
| RTECS | FG4920000 |
| ChEBI | 38825 |
| ChemSpider | 6153 |
| ECHA InfoCard | 100.000.815 |
| Безопасность | |
| Предельная концентрация | 3000 мг/м³ |
| Токсичность | Нетоксичен. Не обладает канцерогенными и тератогенными свойствами. |
| NFPA 704 | |
Физические свойства
При комнатной температуре представляет собой химически инертный, бесцветный газ без запаха и вкуса, примерно в 3 раза тяжелее воздуха. Его температура плавления −184 °С и температура кипения −128 °С.
Очень плохо растворим в воде (20 мг/кг при 20 °С[3]), в этаноле (около 80 мг/кг при 25 °С[4]) и бензоле (около 64 мг/кг при 25 °C[5]).
Из 4 фторпроизводных метана, — фторметана, дифторметана, трифторметана и тетрафторметана, связь между атомами фтора и углерода в тетрафторметане является самой прочной. Это обусловлено высокой электроотрицательностью атомов фтора, оттягивающих электронное облако от атома углерода на себя, в результате чего атом углерода оказывается заряжен положительно: +0,76 элементарного заряда и это усиливает кулоновские силы между положительно заряженным атомом углерода и отрицательно заряженными атомами фтора.
Химические свойства
Тетрафторметан, как и другие перфторуглероды весьма устойчив благодаря прочности связи фтор—углерод и является одним из самых стабильных соединений среди всех органических веществ. Энергия связи в этом соединении равна 515 кДж/моль. Поэтому он инертен по отношению к кислотам и основаниям.
При высоких температурах в присутствии кислорода или на воздухе он разлагается с образованием карбонилфторида и оксида углерода (II).
Реагирует с некоторыми активными металлами, и с щелочными металлами:
При контакте тетрафторметана с пламенем в избытке кислорода получаются токсичные газы (карбонилфторид и окись углерода); в присутствии воды образуется фтороводород.
Получение
Чистый тетрафторметан был впервые синтезирован в 1926 году[6].
Тетрафторметан может быть получен в лабораторных условиях при реакции карбида кремния с фтором:
Он также может быть получен фторированием диоксида углерода, окиси углерода или фосгена с помощью тетрафторида серы:
При температуре в 350—375 °C углерод в форме графита реагирует с трифторидом азота:
Одним из способов получения является реакция при температуре выше 900 °C углерода с фтором:
В промышленности, из-за трудности получения элементарного фтора и его дороговизны тетрафторметан получают из дифтордихлорметана или хлортрифторметана воздействием фтороводорода:
В качестве побочного продукта тетрафторметан в промышленности образуется при фторировании любых органических соединений и при получении алюминия электролитическим способом, в ходе электролиза фторидов металлов, входящих в состав криолита с помощью угольного электрода.
Использование
- Тетрафторметан иногда применяют в качестве низкотемпературного хладагента (коммерческие названия фреон-14, хладон-14).
- В микроэлектронике, отдельно, или в сочетании с кислородом в процессах плазменного травления кремния, диоксида кремния или нитрида кремния.
- Компонент дыхательных смесей при глубоководных погружениях.
- В системах автоматического пожаротушения.
- Стабилизатор разложения озона.
- Разбавитель смесей газов при проведении химических реакций.
- Реагент для получения фторорганических соединений.
Воздействие на окружающую среду
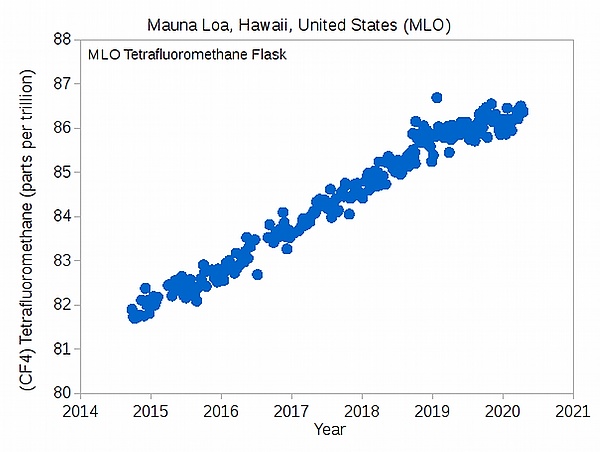
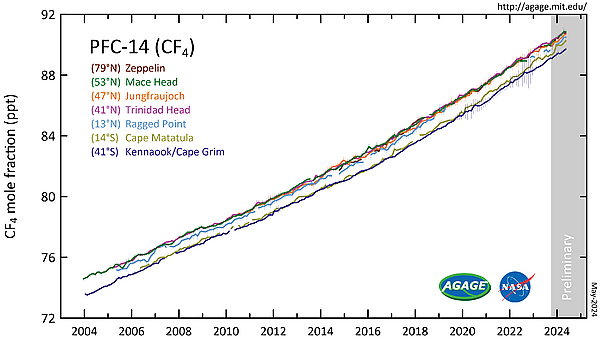
Тетрафторметан является мощным парниковым газом, который способствует парниковому эффекту. Он очень стабилен, имеет время жизни в атмосфере 50 000 лет и высокий потенциал парникового потепления, в 6 500 раз превышающий потенциалCO2.[7]
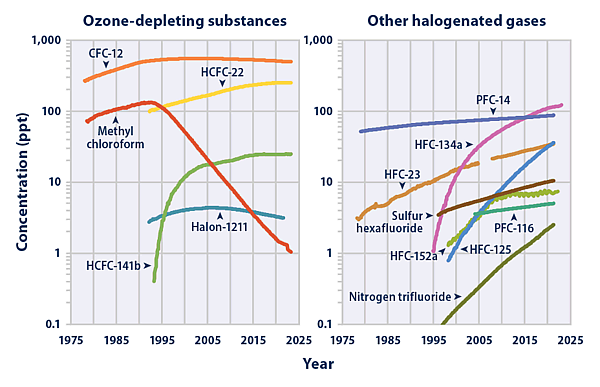
Тетрафторметан является наиболее распростраённым перфторуглеродом в атмосфере, где он обозначается как PFC-14. Его концентрация в атмосфере растёт.[8] По состоянию на 2019 год искусственные газы ХФУ-11 и ХФУ-12 продолжают оказывать более сильное радиационное воздействие, чем ПФУ-14..[9]
Несмотря на структурное сходство с хлорфторуглеродами, тетрафторметан не разрушает озоновый слой[10] потому что углерод-фторсодержащая связь намного сильнее, чем между углеродом и хлором.[11]
Основные промышленные выбросы тетрафторметана, помимо гексафторэтана, образуются при производстве алюминия с использованием процесса Холла-Эру. CF4 также образуется в результате распада более сложных соединений, таких как галоидоуглероды.[12]
Опасность использования
Тетрафторметан нетоксичен, но при длительном вдыхании воздуха с низкими концентрациями возможен наркотический эффект[13].
При вдыхании воздуха с бо́льшими концентрациями возможно кислородное голодание и развитие симптомов, сходных с высотной болезнью — сопровождающиеся головной болью, помутнением сознания, тошнотой, головокружением.
При контакте с кожей сжиженного тетрафторметана возможно обморожение.
Тетрафторметан тяжелее воздуха в три раза, поэтому может скапливаться в нижней части недостаточно проветриваемых помещений, технических колодцев, подвалов, снижая концентрацию кислорода в воздухе . При попадании человека в такую атмосферу возможна его быстрая гибель от удушья.
См. также
Примечания
Ссылки
- Фторуглеродные покрытия// Гиль, Г.С. — 2018.