Озон
Озо́н (от др.-греч. ὄζω — пахну) — состоящая из трёхатомных молекул O3, аллотропная модификация кислорода. При нормальных условиях — голубой газ. Запах — резкий специфический. При сжижении превращается в жидкость цвета индиго. В твёрдом виде представляет собой тёмно-синие, серые, практически чёрные кристаллы.
Что важно знать
| Озон | |
|---|---|
| Общие | |
| Систематическое наименование |
Трикислород |
| Традиционные названия | Озон |
| Хим. формула | O3 |
| Физические свойства | |
| Состояние | голубой газ |
| Молярная масса | 47,998 г/моль |
| Плотность |
0,0021445 г/см³ (газ при 0 °C); 1,59(7) г/см³ (жидкость при 85,2 К); 1,73(2) г/см³ (твёрдый вид при 77,4 К)[1] |
| Поверхностное натяжение |
43,8 Н/м (77,4 К); 38,4 Н/м (90,2 К)[1] Н/м |
| Динамическая вязкость |
4,17 мПа·с (77,6 К); 1,56(2) мПа·с (90,2 К)[1] |
| Энергия ионизации | 12,52 ± 0,01 |
| Термические свойства | |
| Температура | |
| • плавления | −197,2 °C |
| • кипения | −111,9 °C |
| Критическая точка | |
| • температура | −12,0 °С (261,1 К)[1] °C |
| • давление | 54,6 атм.[1] |
| Мол. теплоёмк. | 85,354 − 0,2812·(T − 90) (ж., при T от 90 до 160 К)[1] Дж/(моль·К) |
| Энтальпия | |
| • образования | 144,457 (при 0 К, отн. О2)[1] кДж/моль |
| Коэфф. тепл. расширения |
2,0·10−3 К−1 (жидкость, 90,1 К) 2,5·10−3 К−1 (жидкость, 161 К)[1] |
| Давление пара | 1 ± 1 |
| Химические свойства | |
| Растворимость | |
| • в воде | 1,06 г/л (при 0 °С)[2] |
| Диэлектрическая проницаемость | 1,0019 (г), 4,79 (ж)[1] |
| Оптические свойства | |
| Показатель преломления |
1,0533 (газ, 480 нм) 1,0520 (газ, 546 нм) 1,0502 (газ, 671 нм) 1,2236 (жидкость, 535 нм) 1,2226 (жидкость, 589 нм) 1,2213 (жидкость, 670,5 нм)[1] |
| Структура | |
| Дипольный момент | 0,5337 Д |
| Классификация | |
| Рег. номер CAS | 10028-15-6 |
| 3D model (JSmol) | Интерактивная схема |
| PubChem | 24823 |
| UNII | 66H7ZZK23N |
| CompTox Dashboard EPA | DTXSID0021098 |
| Рег. номер EINECS | 233-069-2 |
| SMILES | |
| InChI | |
| RTECS | RS8225000 |
| ChEBI | 25812 |
| ChemSpider | 23208 |
| ECHA InfoCard | 100.030.051 |
| Безопасность | |
| ЛД50 | 4,8 ppm |
| Пиктограммы СГС |
|
| NFPA 704 | |
Строение озона
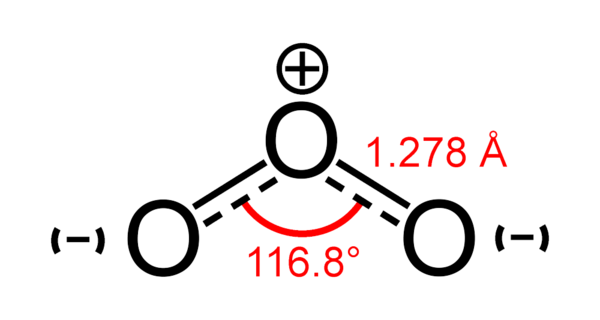
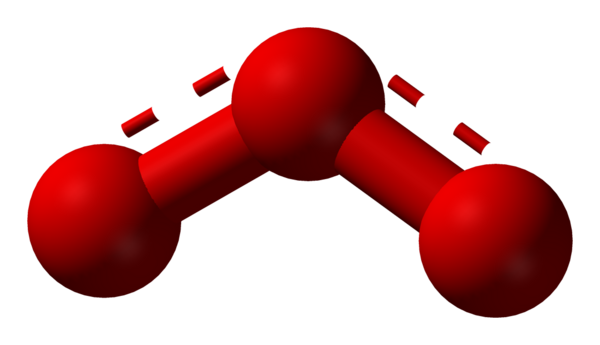
Обе связи O—O в молекуле озона имеют одинаковую длину 1,278 Å. Угол между связями составляет 116,8°[3]. Центральный атом кислорода sp²-гибридизован, имеет одну неподелённую пару электронов. Порядок каждой связи — 1,5, резонансные структуры — с локализованной одинарной связью с одним атомом и двойной — с другим, и наоборот. Молекула полярна, электрический дипольный момент — 0,5337 Д[4].
История открытия
Впервые озон обнаружил в 1785 году голландский физик М. ван Марум по характерному запаху и окислительным свойствам, которые приобретает воздух после пропускания через него электрических искр, а также по способности действовать на ртуть при обыкновенной температуре, вследствие чего она теряет свой блеск и начинает прилипать к стеклу[5]. Однако как новое вещество он описан не был, ван Марум считал, что образуется особая «электрическая материя».
Термин озон был предложен немецким химиком X. Ф. Шёнбейном в 1840 году за его пахучесть, вошёл в словари в конце XIX века. Многие источники именно ему отдают приоритет открытия озона в 1839 году. В 1840 году Шёнбейн показал способность озона вытеснять иод из иодида калия[5]:
Эту реакцию используют для качественного определения озона с помощью фильтровальной бумаги, пропитанной смесью растворов крахмала и иодида калия (иодкрахмальной бумаги) — она в озоне синеет ввиду взаимодействия выделяющегося иода с крахмалом[6].
Факт уменьшения объёма газа при превращении кислорода в озон экспериментально доказали в 1860 году Эндрюс и Тэт при помощи стеклянной трубки с манометром, наполненной чистым кислородом, со впаянными в неё платиновыми проводниками для получения электрического разряда[5].
Получение озона
Озон образуется во многих процессах, сопровождающихся выделением атомарного кислорода, например при разложении перекисей, окислении фосфора и т. п.
В промышленности его получают из воздуха или кислорода в озонаторах действием электрического разряда. Сжижается O3 легче, чем O2, и потому их несложно разделить. Озон для озонотерапии в медицине получают только из чистого кислорода. При облучении воздуха жёстким ультрафиолетовым излучением образуется озон. Тот же процесс протекает в верхних слоях атмосферы, где под действием солнечного излучения образуется и поддерживается озоновый слой.
В лаборатории озон можно получить взаимодействием охлаждённой концентрированной серной кислоты с пероксидом бария[6]:
Физические свойства
- Молекулярная масса — 48 а. е. м.
- Плотность газа при нормальных условиях 2,1445 г/дм³. Относительная плотность газа по кислороду 1,5; по воздуху 1,62 (1,658[7]).
- Плотность жидкости при −188 °C (85,2 К) составляет 1,59(7) г/см³[1].
- Плотность твёрдого озона при −195,7 °С (77,4 К) равна 1,73(2) г/см³[1].
- Температура кипения −111,8(3) °C (161,3 К)[1]. Жидкий озон — тёмно-фиолетового цвета.
- Температура плавления −197,2(2) °С (75,9 К). Приводимая иногда температура плавления −251,4 °C (21,7 К) ошибочна, так как при её определении не учитывалась большая способность озона к переохлаждению[8]. По другим сведениям[1] Tпл = −192,5(4) °С (80,6 К). В твёрдом состоянии — чёрного цвета с фиолетовым отблеском.
- Критическая температура −12,0 °С (261,1 К)[1].
- Критическое давление 51,6 атм[1].
- Коэффициент диффузии (при 300 К, 1 атм) 0,157 см²/с[1].
- Теплота плавления 2,1 кДж/моль[1].
- Теплота испарения при температуре кипения в различных источниках указывается от 11,17 до 15,19 кДж/моль[1]; при 90 К от 15,27 до 16,6 кДж/моль[1].
- Растворимость в воде при 0 °С — 0,394 кг/м³ (0,494 л/кг), она в 10 раз выше по сравнению с кислородом. Кажущаяся растворимость сильно зависит от чистоты воды, поскольку примеси катализируют распад озона.
- Жидкий озон смешивается во всех отношениях с жидкими аргоном, азотом, фтором, метаном, углекислотой, тетрахлоруглеродом. Смешивается с жидким кислородом во всех отношениях при температуре выше 93 К, ниже этой температуры раствор расслаивается на две фазы[1].
- Хорошо растворяется в фреонах, образуя стабильные растворы (используется для хранения и перевозки).
- Потенциал ионизации молекулы 12,52 эВ[1].
- В газообразном состоянии озон диамагнитен, в жидком — слабопарамагнитен.
- Запах — резкий, специфический «металлический» (по Менделееву — «запах раков»). При больших концентрациях напоминает запах хлора. Запах ощутим даже при разбавлении 1:100 000.
Химические свойства
Образование озона проходит по обратимой реакции:
Молекула О3 неустойчива и при достаточных концентрациях в воздухе при нормальных условиях самопроизвольно за несколько десятков минут[9] превращается в O2 с выделением тепла. Повышение температуры и понижение давления увеличивают скорость перехода в двухатомное состояние. При больших концентрациях переход может носить взрывной характер. Контакт озона даже с малыми количествами органических веществ, некоторых металлов или их окислов резко ускоряет превращение.
В присутствии небольших количеств азотной кислоты озон стабилизируется, а в герметичных сосудах из стекла, некоторых пластмасс или чистых металлов озон при низких температурах (−78 °С) практически не разлагается.
Озон — мощный окислитель, намного более реакционноспособный, чем двухатомный кислород. Окисляет почти все металлы (за исключением золота, платины[10] и иридия) до их высших степеней окисления (после некоторого поверхностного окисления довольно хорошо противостоят действию озона Ni, Cu, Sn)[11]. Окисляет многие неметаллы. Продуктом реакции в основном является кислород.
Озон повышает степень окисления оксидов:
Эта реакция сопровождается хемилюминесценцией. Диоксид азота может быть окислен до азотного ангидрида:
Озон не реагирует с молекулярным азотом при комнатной температуре, но при 295°С вступает с ним в реакцию:
Озон реагирует с углеродом при нормальной температуре с образованием диоксида углерода:
Озон не реагирует с аммониевыми солями, но реагирует с аммиаком с образованием нитрата аммония:
Озон реагирует с водородом с образованием воды и кислорода:
Озон реагирует с сульфидами с образованием сульфатов:
С помощью озона можно получить серную кислоту как из элементарной серы, так и из диоксида серы и сероводорода:
В газовой фазе озон взаимодействует с сероводородом с образованием диоксида серы:
В водном растворе проходят две конкурирующие реакции с сероводородом, одна с образованием элементарной серы, другая с образованием серной кислоты:
Все три атома кислорода в озоне могут реагировать по отдельности в реакции хлорида олова с соляной кислотой и озоном:
Обработкой озоном раствора иода в холодной безводной хлорной кислоте может быть получен перхлорат иода(III):
Твёрдый перхлорат нитрония может быть получен реакцией газообразных NO2, ClO2 и O3:
Озон может участвовать в реакциях горения, при этом температуры горения выше, чем с двухатомным кислородом:
Озон может вступать в химические реакции и при низких температурах. При 77 K (−196 °C, температура кипения жидкого азота), атомарный водород взаимодействует с озоном с образованием гидропероксидного радикала с димеризацией последнего[12]:
Озон может образовывать неорганические озониды, содержащие анион O3−. Эти соединения взрывоопасны и могут храниться только при низких температурах. Известны озониды всех щелочных металлов (кроме франция). KO3, RbO3 и CsO3 могут быть получены из соответствующих супероксидов:
Озонид калия может быть получен и другим путём из гидроксида калия[13]:
NaO3 и LiO3 могут быть получены действием CsO3 в жидком аммиаке NH3 на ионообменные смолы, содержащие ионы Na+ или Li+[14]:
Обработка озоном раствора кальция в аммиаке приводит к образованию озонида аммония, а не кальция[12]:
Озон может быть использован для удаления железа и марганца из воды с образованием осадка (соответственно гидроксида железа(III) и диоксигидрата марганца), который может быть отделён фильтрованием:
В кислых средах окисление марганца может идти до перманганата.
Озон превращает токсичные цианиды в менее опасные цианаты:
Озон может полностью разлагать мочевину[15] :
Взаимодействие озона с органическими соединениями с активированным или третичным атомом углерода при низких температурах приводит к соответствующим гидротриоксидам. Реакция озона с непредельными соединениями с образованием органических озонидов находит применение в анализе органических веществ.
Токсичность
В умеренных концентрациях озон не токсичен. Однако высокая окисляющая способность озона и образование во многих реакциях с его участием свободных радикалов кислорода определяют его токсичность (в больших концентрациях). Чрезмерное воздействие озона на организм может приводить к преждевременной смерти.
Наиболее опасное воздействие высоких концентраций озона в воздухе:
- на органы дыхания прямым раздражением;
Озон в Российской Федерации отнесён к первому, самому высокому классу опасности вредных веществ. Нормативы по озону:
- максимальная разовая предельно допустимая концентрация (ПДК м.р.) в атмосферном воздухе населённых мест 0,16 мг/м³[16];
- среднесуточная предельно допустимая концентрация (ПДК с.с.) в атмосферном воздухе населённых мест 0,03 мг/м³[16];
- предельно допустимая концентрация (ПДК) в воздухе рабочей зоны 0,1 мг/м³;
- минимальная смертельная концентрация (LC50) — 4,8 ppm.
Порог человеческого обоняния приближённо равен 0,01 мг/м³[17].
Озон эффективно уничтожает плесень, бактерии и вирусы.
Применение озона
Применение озона обусловлено его свойствами:
- сильного окисляющего реагента:
- для стерилизации изделий медицинского назначения;
- при получении многих веществ в лабораторной и промышленной практике;
- для отбеливания бумаги;
- для очистки масел.
- сильного дезинфицирующего средства:
- для очистки воды и воздуха от микроорганизмов (озонирование);
- для дезинфекции помещений и одежды;
- для озонирования растворов, применяемых в медицине (как для внутривенного, так и для контактного применения).
Существенными достоинствами озонирования, по сравнению с хлорированием, является отсутствие[17] токсинов (кроме формальдегида) в обработанной воде (тогда как при хлорировании возможно образование существенного количества хлорорганических соединений, многие из которых токсичны, например, диоксин) и лучшая, по сравнению с кислородом, растворимость в воде.
Давно рассматривается применение озона в качестве высокоэнергетического и вместе с тем экологически чистого окислителя в ракетной технике[18]. Общая химическая энергия, освобождающаяся при реакции сгорания с участием озона, больше, чем для простого кислорода, примерно на одну четверть (719 ккал/кг). Больше будет, соответственно, и удельный импульс. У жидкого озона большая плотность, чем у жидкого кислорода (1,35 и 1,14 г/см³ соответственно), а его температура кипения выше (−112 °C и −183 °C соответственно), поэтому в этом отношении преимущество в качестве окислителя в ракетной технике больше у жидкого озона. Однако препятствием является химическая неустойчивость и взрывоопасность жидкого озона с разложением его на O и O2, при котором возникает движущаяся со скоростью около 2 км/с детонационная волна и развивается разрушающее детонационное давление более 3·107 дин/см² (3 МПа), что делает применение жидкого озона невозможным при нынешнем уровне техники, за исключением использования устойчивых кислород-озоновых смесей (до 24 % озона). Преимуществом подобной смеси также является больший удельный импульс (УИ) для водородных двигателей, по сравнению с озон-водородными[19]. На сегодняшний день такие высокоэффективные двигатели, как РД-170, РД-180, РД-191, а также разгонные вакуумные двигатели вышли по УИ на близкие к предельным параметры, и для повышения удельного импульса необходимо найти возможность перейти на новые виды топлива.
Жидкий озон при низких температурах (в жидком азоте) также иногда применяется в органическом синтезе для мягкого разрыва двойной углерод-углеродной связи.
Озон в атмосфере
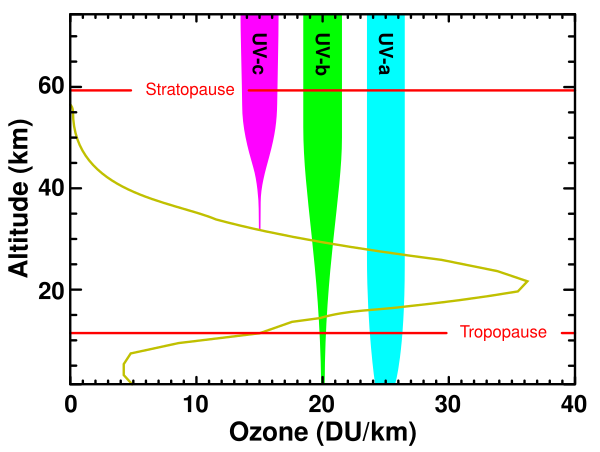
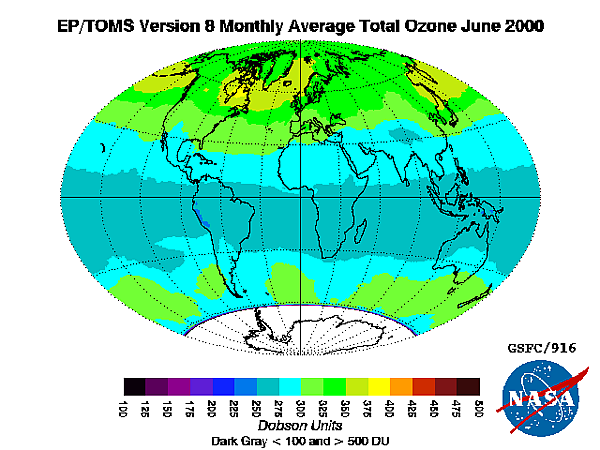
Стандартным способом выражения общего уровня озона (количества озона в данной вертикальной колонке) в атмосфере является использование единиц Добсона. Точечные измерения представляются в виде молярных долей в нмоль/моль (частей на миллиард, ppb) или в виде концентраций в мкг/м3. Изучение концентрации озона в атмосфере началось в 1920-х .[20]
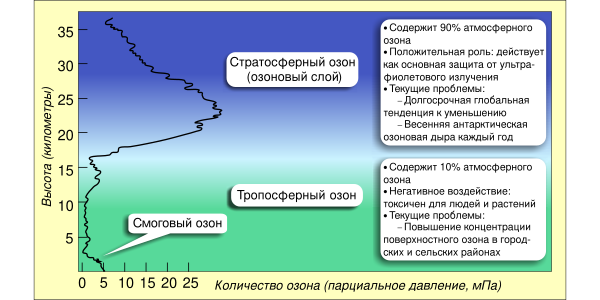
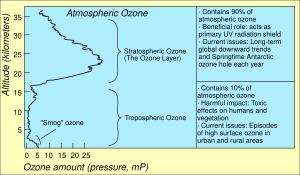
Самые высокие уровни озона в атмосфере находятся в стратосфере, в области, также известной как озоновый слой, на высоте от 10 до 50 км над поверхностью. Однако даже в этом «слое» концентрация озона составляет всего от двух до восьми частей на миллион, поэтому большая часть кислорода там — это дикислород,О2, около 210 000 частей на миллион по объёму.[21]
Озон в стратосфере в основном образуется из коротковолновых ультрафиолетовых лучей с длиной волны от 240 до 160 нм. Кислород начинает слабо поглощаться на длине волны 240 нм в полосах Герцберга, но большая часть кислорода диссоциирует при поглощении в сильных полосах Шумана-Рунге между 200 и 160 нм, где озон не поглощает. В то время как свет с более короткой длиной волны, простирающийся даже до рентгеновского предела, достаточно энергичен для диссоциации молекулярного кислорода, его относительно мало, и сильное солнечное излучение на Лайман-альфа, 121 нм, падает в точке, где молекулярное поглощение кислорода минимально.[22]
Процесс создания и разрушения озона называется циклом Чепмена и начинается с фотолиза молекулярного кислорода
Затем следует реакция атома кислорода с другой молекулой кислорода с образованием озона
где «М» обозначает третье тело, которое уносит с собой избыточную энергию реакции. Затем молекула озона может поглощать фотон УФ-С и диссоциировать
Избыточная кинетическая энергия нагревает стратосферу, когда атомы О и молекулярный кислород разлетаются и сталкиваются с другими молекулами. Это преобразование ультрафиолетового света в кинетическую энергию нагревает стратосферу. Атомы кислорода, образующиеся при фотолизе озона, затем вступают в реакцию с другой молекулой кислорода, как и на предыдущем этапе, образуя больше озона. В чистой атмосфере, где есть только азот и кислород, озон может вступать в реакцию с атомарным кислородом с образованием двух молекул O2:
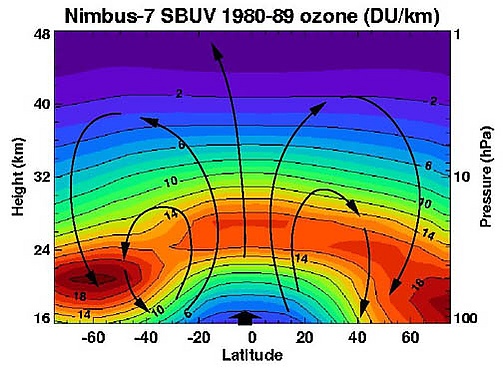
Оценить скорость этого завершающего этапа круговорота атомарного кислорода обратно в озон можно, просто взяв отношения концентрацийО2 кО3. Реакция терминации катализируется присутствием определённых свободных радикалов, наиболее важными из которых являются гидроксил (OH), оксид азота (NO) и атомарный хлор (Cl) и бром (Br). Во второй половине 20-го века было обнаружено, что количество озона в стратосфере уменьшается, в основном из-за увеличения концентраций хлорфторуглеродов (ХФУ) и подобных хлорированных и бромированных органических молекул. Обеспокоенность по поводу последствий снижения концентрации озона для здоровья привела к принятию в 1987 году Монреальского протокола, запрету на производство многих озоноразрушающих химических веществ, а в первом и втором десятилетии XXI века положило начало восстановлению концентраций стратосферного озона.
Озон в озоновом слое отфильтровывает солнечные лучи с длиной волны от 200 нм до 315 нм, с пиком поглощения озона на длине волны около 250 нм.[23] Это поглощение озона УФ-излучением важно для жизни, поскольку оно продлевает поглощение УФ-излучения обычным кислородом и азотом в воздухе (которые поглощают все длины волн < 200 нм) через нижнюю УФ-С (200—280 нм) и всю УФ-В полосу (280—315 нм). Небольшая неабсорбированная часть, остающаяся от УФ-В после прохождения через озон, вызывает солнечные ожоги у людей и прямое повреждение ДНК в живых тканях как у растений, так и у животных. Влияние озона на УФ-В лучи среднего уровня иллюстрируется его воздействием на УФ-В на длине волны 290 нм, интенсивность излучения которого в верхних слоях атмосферы в 350 миллионов раз выше, чем на поверхности. Тем не менее, достаточное количество УФ-В излучения с одинаковой частотой достигает земли, чтобы вызвать солнечные ожоги, и эти же длины волн также отвечают за выработку витамина D у людей.
Озоновый слой оказывает незначительное влияние на более длинные ультрафиолетовые волны, называемые UV-A (315—400 нм), но это излучение не вызывает солнечных ожогов или прямого повреждения ДНК. В то время как УФ-А, вероятно, вызывает долгосрочные повреждения кожи у некоторых людей, он не так опасен для растений и здоровья наземных организмов на Земле в целом (см. Ультрафиолет для получения дополнительной информации о ближнем ультрафиолете).
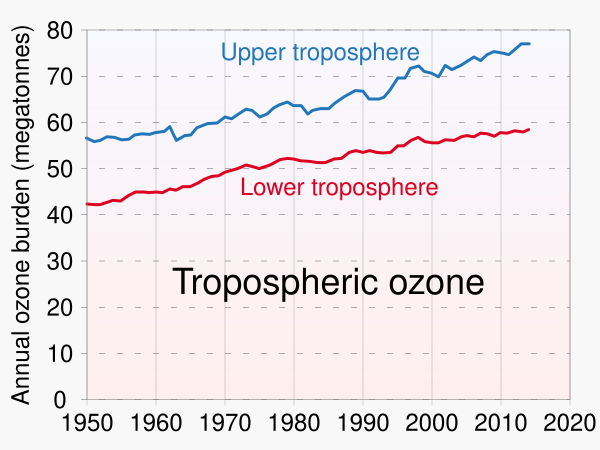
Приземный озон (или тропосферный озон) является загрязнителем атмосферы.[24] Он не выделяется непосредственно автомобильными двигателями или промышленными операциями, а образуется в результате реакции солнечного света на воздух, содержащий углеводороды и оксиды азота, которые вступают в реакцию с образованием озона непосредственно у источника загрязнения или за много километров с подветренной стороны.
Озон вступает в непосредственную реакцию с некоторыми углеводородами, такими как альдегиды, и таким образом начинает их удаление из воздуха, но продукты сами по себе являются ключевыми компонентами смога. Фотолиз озона под действием ультрафиолетового излучения приводит к образованию гидроксильного радикала HO•, который играет роль в удалении углеводородов из воздуха, а также является первым шагом в создании компонентов смога, таких как пероксиацилнитраты, которые могут быть мощными раздражителями глаз. Время жизни тропосферного озона в атмосфере составляет около 22 дней; его основные механизмы удаления осаждаются на землю, причём вышеупомянутая реакция даёт HO•, а в результате реакции с ОН и пероксирадикалом HO2'..[25]
Имеются данные о значительном снижении урожайности сельскохозяйственных культур из-за повышения приземного озона и загрязнения, что препятствует фотосинтезу и замедляет общий рост некоторых видов растений.[26][27] Агентство по охране окружающей среды США предложило вторичное регулирование для снижения ущерба урожаю, в дополнение к основному постановлению, предназначенному для защиты здоровья человека.
Некоторыми примерами городов с повышенными показателями озона являются Денвер, штат Колорадо; Хьюстон, штат Техас; и Мехико, Мексика. В Хьюстоне показатель составляет около 41 нмоль/моль, в то время как в Мехико этот показатель гораздо более опасен, с показателем около 125 нмоль/моль.[27]
Приземный озон, или тропосферный озон, является наиболее тревожным типом загрязнения озоном в городских районах и в целом продолжает расти.[28] Загрязнение озоном в городских районах затрагивает более плотное население и усугубляется большим скоплением транспортных средств, которые выбрасывают загрязняющие веществаNO2 и ЛОС, которые являются основными факторами проблемного уровня озона.[29] Загрязнение озоном в городских районах особенно тревожно в связи с повышением температуры, что приводит к увеличению смертности, связанной с жарой, во время периодов сильной жары[30]Во время аномальной жары в городских районах загрязнение озоном на уровне земли может быть на 20 % выше, чем обычно.[31] Загрязнение озоном в городских районах достигает более высоких уровней превышения летом и осенью, что может объясняться погодными условиями и схемами дорожного движения[29] Люди, живущие в бедности, в большей степени страдают от загрязнения окружающей среды, хотя эти группы населения с меньшей вероятностью вносят свой вклад в уровень загрязнения.[32]
Как упоминалось выше, Денвер, штат Колорадо, является одним из многих городов в США, которые имеют большое количество озона. По данным Американской ассоциации лёгких, район Денвер-Аврора является 14-м наиболее загрязнённым озоном районом в США.[33] Проблема высокого уровня содержания озона в этом районе не нова. В 2004 году Агентство по охране окружающей среды присвоило Денверскому метрополитену Северному переднему хребту статус зоны, не отвечающей требованиям по 8-часовому стандарту на содержание озона в 1997 году, но позже отложило принятие этого статуса до 2007 года. Стандарт несоблюдения требований указывает на то, что данная территория не соответствует стандартам качества воздуха, установленным Агентством по охране окружающей среды. В ответ на это был разработан План действий по борьбе с озоном в Колорадо, и в него были внесены многочисленные изменения. Первым важным изменением стало то, что проверка выбросов автомобилей была расширена по всему штату на большее количество округов, в которых ранее не проводилась обязательная проверка выбросов, например, в округах Лаример и Уэлд. Также были внесены изменения для снижения выбросов оксидов азота и летучих органических соединений, что должно способствовать снижению уровня озона.
Одним из основных факторов, способствующих повышению уровня озона в этом районе, является нефтяная и газовая промышленность, расположенная в бассейне Денвер-Джулсбург, который пересекается с большинством мегаполисов Колорадо. Озон естественным образом образуется в стратосфере Земли, но также образуется в тропосфере в результате усилий человека. Кратко упомянутые выше, NOx и ЛОС вступают в реакцию с солнечным светом с образованием озона с помощью процесса, называемого фотохимией. События повышенного озона в течение одного часа (<75 ppb) «происходят в период с июня по август, что указывает на то, что повышенный уровень озона обусловлен региональной фотохимией».[34] Согласно статье из Университета Колорадо в Боулдере, «выбросы ЛОС в нефти и природном газе играют важную роль в производстве озона и могут способствоватьповышению уровня О3 в Северном Колорадском фронтовом хребте».[34] Используя комплексный анализ для изучения ветровых режимов и выбросов от крупных нефтяных и газовых месторождений, авторы пришли к выводу, что "повышенные уровниO3 в NCFR преимущественно коррелируют с воздушным переносом с севера на юго-восток, которые являются наветренными секторами, где расположены операции по добыче нефти и газа в районе месторождения Ваттенберг[34]
В Плане действий по озону в Колорадо, созданном в 2008 году, существуют планы по оценке «контроля выбросов для крупных промышленных источников NOx» и «требований к контролю в масштабах штата для новых резервуаров для нефтяного и газового конденсата и пневматических клапанов».[35] В 2011 году был выпущен Региональный план по борьбе с дымкой, который включал в себя более конкретный план по сокращению выбросов NOx. Эти усилия становится все труднее реализовать, и на их реализацию уходит много лет. Конечно, есть и другие причины, по которым уровень озона остаётся высоким. К ним относятся: растущее население, означающее увеличение выбросов от автомобилей, и горы вдоль NCFR, которые могут задерживать выбросы. Если вам интересно, ежедневные показания о качестве воздуха можно найти на веб-сайте Департамента общественного здравоохранения и окружающей среды штата Колорадо.[36] Как отмечалось ранее, в Денвере и по сей день сохраняется высокий уровень озона. Потребуется много лет и системный подход для борьбы с проблемой высокого уровня озона в Переднем хребте Колорадо.
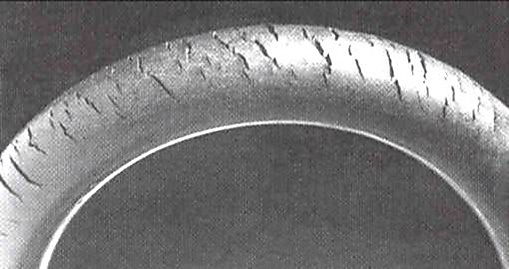
Озон атакует любой полимер, обладающий олефиновыми или двойными связями в своей цепной структуре, такой как натуральный каучук, нитриловый каучук и бутадиен-стирольный каучук. Изделия, изготовленные с использованием этих полимеров, особенно подвержены воздействию, из-за чего трещины со временем становятся длиннее и глубже, скорость роста трещин зависит от нагрузки, которую несёт резиновый компонент, и концентрации озона в атмосфере. Такие материалы можно защитить, добавив антиозонанты, такие как воск, которые сцепляются с поверхностью, создавая защитную плёнку или смешиваясь с материалом и обеспечивая долгосрочную защиту. Например, растрескивание озона раньше было серьёзной проблемой в автомобильных шинах в современных шинах это не проблема. С другой стороны, многие критически важные продукты, такие как прокладки и уплотнительные кольца, могут подвергаться воздействию озона, образующегося в системах сжатого воздуха. Топливопроводы, изготовленные из армированной резины, также подвержены атаке, особенно в моторном отсеке, где некоторое количество озона вырабатывается электрическими компонентами. Хранение резиновых изделий в непосредственной близости от электродвигателя постоянного тока может ускорить растрескивание озона. Коллектор двигателя генерирует искры, которые, в свою очередь, производят озон.
Хотя до промышленной революции озон присутствовал на приземном уровне, в настоящее время пиковые концентрации намного выше, чем доиндустриальные уровни, и даже фоновые концентрации вдали от источников загрязнения значительно выше.[38][39] Озон действует как парниковый газ, поглощая часть инфракрасной энергии, излучаемой Землёй. Количественная оценка активности парниковых газов озона затруднена, потому что он не присутствует в одинаковых концентрациях по всему земному шару. Тем не менее, наиболее широко признанные научные оценки, связанные с изменением климата (например, Третий оценочный доклад Межправительственной группы экспертов по изменению климата)[40] предполагают, что радиационное воздействие тропосферного озона составляет около 25 % от воздействия углекислого газа.
Годовой потенциал тропосферного озона к глобальному потеплению составляет от 918 до 1022 тонн эквивалента углекислого газа на тонну тропосферного озона. Это означает, что в расчёте на молекулу озон в тропосфере оказывает радиационное воздействие примерно в 1000 раз сильнее, чем углекислый газ. Однако тропосферный озон является короткоживущим парниковым газом, который распадается в атмосфере гораздо быстрее, чем углекислый газ. Это означает, что в течение 20-летнего периода потенциал глобального потепления тропосферного озона намного меньше, примерно от 62 до 69 тонн эквивалента углекислого газа на тонну тропосферного озона[41]
Из-за своей коротковременной природы тропосферный озон не оказывает сильного глобального воздействия, но оказывает очень сильное радиационное воздействие в региональном масштабе. На самом деле, в мире есть регионы, где тропосферный озон оказывает радиационное воздействие до 150 % углекислого газа.[42] Например, показано, что увеличение озона в тропосфере является причиной ~30 % внутреннего потепления в верхней части Южного океана в период между 1955 и 2000 годами.[43]
Примечания
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1992. — Т. 3 (Мед-Пол). — 639 с. — ISBN 5-82270-039-8.
- Разумовский С. Д., Заиков Г. Е. Озон и его реакции с органическими соединениями (кинетика и механизм). — М.: Наука, 1974. — 322 с.
- Лунин В. В., Попович М. П., Ткаченко С. Н. Физическая химия озона. — М.: МГУ, 1998. — 480 с. — ISBN 5-211-03719-7.
- Озон — не всегда хорошо // Наука и жизнь : журнал. — 1992. — № 8. — С. 155.


































![{\displaystyle {\ce {O2->[{\ce {photon}}][({\ce {radiation}}\ \lambda \ <\ 240\ {\ce {nm}})]2O}}}](https://ru.ruwiki.ru/api/rest_v1/media/math/render/svg/22c15c0d1b053ba02c27ceed129794d2cb91dd2a)