Электроотрицательность
Эле́ктроотрица́тельность (χ) (относительная электроотрицательность) — фундаментальное химическое свойство атома, количественная характеристика способности атома в молекуле смещать к себе общие электронные пары, то есть способность атомов притягивать к себе электроны других атомов. Самая высокая степень электроотрицательности у галогенов и сильных окислителей (p-элементов, F, O, N, Cl), а низкая — у активных металлов (s-элементов I группы, Na, K, Cs).[источник не указан 1604 дня]
Описание
Современное понятие об электроотрицательности атомов было введено американским химиком Л. Полингом. Он использовал понятие электроотрицательности для объяснения того факта, что энергия гетероатомной связи A—B (A, B — символы любых химических элементов) в общем случае больше среднего геометрического значения гомоатомных связей A—A и B—B.[источник не указан 1604 дня]
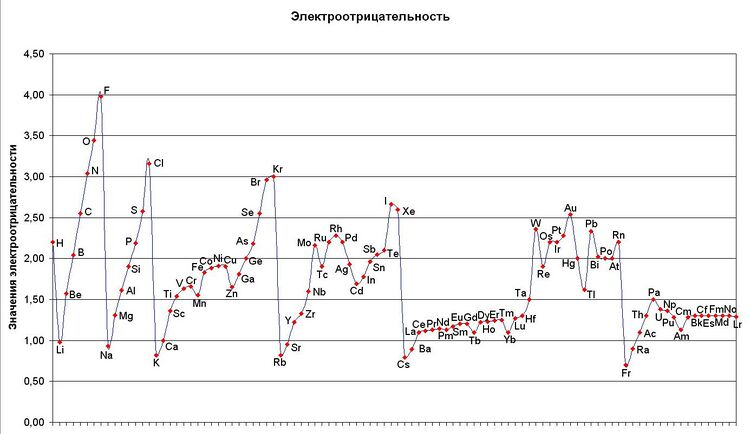
Первая и широко известная (самая распространённая) шкала относительных атомных электроотрицательностей Полинга охватывает значения от 0,7 для атомов франция до 4,0 для атомов фтора. Фтор — наиболее электроотрицательный элемент, за ним следует кислород (3,5) и далее азот и хлор (щелочные и щёлочноземельные металлы имеют наименьшие значения электроотрицательности, лежащие в интервале 0,7—1,2, а галогены — наибольшие значения, находящиеся в интервале 4,0—2,5. Электроотрицательность типичных неметаллов находится в середине общего интервала значений и, как правило, близка к 2 или немного больше 2. Электроотрицательность водорода принята равной 2,2[1]. Для большинства переходных металлов значения электроотрицательности лежат в интервале 1,5—2,0. Близки к 2,0 значения электроотрицательностей тяжёлых элементов главных подгрупп. Существует также несколько других шкал электроотрицательности, в основу которых положены разные свойства веществ. Но относительное расположение элементов в них примерно одинаково.[источник не указан 1604 дня]
Теоретическое определение электроотрицательности было предложено американским физиком Р. Малликеном. Исходя из очевидного положения о том, что способность атома в молекуле притягивать к себе электронный заряд зависит от энергии ионизации атома и его сродства к электрону, Р. Малликен ввёл представление об электроотрицательности атома А как о средней величине энергии связи наружных электронов при ионизации валентных состояний (например, от А− до А+) и на этой основе предложил очень простое соотношение для электроотрицательности атома[2][3]:
- где — энергия ионизации атома,
- — сродство к электрону.
В настоящее время для определения электроотрицательностей атомов существует много различных методов, результаты которых хорошо согласуются друг с другом, за исключением относительно небольших различий, и во всяком случае внутренне непротиворечивы.
Помимо шкалы Малликена, описанной выше, существует более 20 различных других шкал электроотрицательности (в основу расчёта значений которых положены разные свойства веществ), среди которых шкала Л. Полинга (основана на энергии связи при образовании сложного вещества из простых), шкала Олреда — Рохова (основана на электростатической силе, действующей на внешний электрон), шкала Оганова[4][5][6] и др. Формула, предложенная Огановым в 2021 году, учитывает ионную стабилизацию молекулы как мультипликативную компоненту и позволяет расчет с большей точностью как при маленьких разностях в электроотрицательности, так и при больших[4]. В 2022 году Сяо Дун из Нанькайского университета, Оганов и др. вычислили электроотрицательности для химических элементов при высоких давлениях: 500 тыс. атм, 2 млн атм и 5 млн атм[7].
| Элемент | шкала
Полинга (eV−1/2) |
шкала
Малликена (eV) |
шкала
Аллена (eV) |
шкала
Мартынова и Бацанова (eV−1/2) |
шкала
Оганова (безразмерные значения) |
| H | 2,2[8] | 7,18 | 2,3 | - | 3,04 |
| Li | 0,98 | 3 | 0,912 | 0,95 | 2,17 |
| Na | 0,93 | 2,84 | 0,869 | 0,9 | 2,15 |
| K | 0,82 | 2,42 | 0,734 | 0,8 | 2,07 |
| Rb | 0,82 | 2,33 | 0,706 | 0,8 | 2,07 |
| Cs | 0,79 | 2,18 | 0,659 | 0,75 | 1,97 |
| Fr | 0,7 | 2,21 | 0,67 | 0,7 | 2,01 |
| Be | 1,57 | 4,41 | 1,576 | 1,5 | 2,42 |
| Mg | 1,31 | 3,62 | 1,293 | 1,2 | 2,39 |
| Ca | 1 | 3,07 | 1,034 | 1 | 2,2 |
| Sr | 0,95 | 2,87 | 0,963 | 1 | 2,13 |
| Ba | 0,89 | 2,68 | 0,881 | 0,9 | 2,02 |
| Ra | 0,9 | 2,69 | 0,89 | 0,9 | - |
| Sc | 1,36 | 3,37 | 1,19 | 1,3 | 2,35 |
| Ti | 1,54 | 3,45 | 1,38 | 1,6 | 2,23 |
| V | 1,63 | 3,64 | 1,53 | (II) 1.5 (III) 1.7 (V) 2.00 | 2,08 |
| Cr | 1,66 | 3,72 | 1,65 | (II) 1.6 (III) 1.8 (V) 2.2 | 2,12 |
| Mn | 1,55 | 3,46 | 1,75 | (II) 1.5 (III) 1.8 (IV) 2.0 (VII) 2.3 | 2,2 |
| Fe | 1,83 | 4,03 | 1,8 | (II) 1.8 (III) 1.9 | 2,32 |
| Co | 1,88 | 4,27 | 1,84 | (II) 1.8 (III) 2.0 (IV) 3.1 | 2,34 |
| Ni | 1,91 | 4,4 | 1,88 | (II) 1.9 (III) 2.0 (IV) 3.4 | 2,32 |
| Cu | 1,9 | 4,48 | 1,85 | (I) 1.8) (II) 2.1 | 2,86 |
| Zn | 1,65 | 4,4 | 1,59 | 1,6 | 2,26 |
| Y | 1,22 | 3,26 | 1,12 | 1,25 | 2,52 |
| Zr | 1,33 | 3,53 | 1,32 | 1,5 | 2,05 |
| Nb | 1,6 | 3,84 | 1,41 | (III) 1.6 (V) 1.9 | 2,59 |
| Mo | 2,16 | 3,92 | 1,47 | (IV) 1.8 (VI) 2.2 | 2,47 |
| Tc | 1,9 | 3,91 | 1,51 | (IV) 1.9 | 2,82 |
| Ru | 2,2 | 4,2 | 1,54 | (II) 2.0 (III) 2.0 (IV) 2.1 | 2,68 |
| Rh | 2,28 | 4,3 | 1,56 | (II) 2.1 (III) 2.1 | 2,65 |
| Pd | 2,2 | 4,45 | 1,58 | (II) 2.2 (III) 2.2 (IV) 2.3 | 2,7 |
| Ag | 1,93 | 4,44 | 1,87 | 1,9 | 2,88 |
| Cd | 1,69 | 4,14 | 1,52 | 1,7 | 2,36 |
| Hf | 1,3 | 3,5 | 1,16 | 1,4 | 2,01 |
| Ta | 1,5 | 4,1 | 1,34 | (III) 1.5 (V) 1.8 | 2,32 |
| W | 2,36 | 4,4 | 1,47 | (IV) 1.8 (V) 2.1 | 2,42 |
| Re | 1,9 | 3,97 | 1,6 | (IV) 1.9 | 2,59 |
| Os | 2,2 | 4,89 | 1,65 | (II) 2.0 (III) 2.1 (IV) 2.2 | 2,72 |
| Ir | 2,2 | 5,34 | 1,68 | (II) 2.1 (III) 2.2 | 2,79 |
| Pt | 2,28 | 5,57 | 1,72 | (II) 2.3 (III) 2.3 (IV) 2.4 | 2,98 |
| Au | 2,54 | 5,77 | 1,92 | (I) 2.0 (III) 2.4 | 2,81 |
| Hg | 2 | 4,97 | 1,76 | 1,8 | 2,92 |
| B | 2,04 | 4,29 | 2,05 | 1,9 | 3,04 |
| Al | 1,61 | 3,21 | 1,613 | 1,5 | 2,52 |
| Ga | 1,81 | 3,21 | 1,756 | 1,7 | 2,43 |
| In | 1,78 | 3,09 | 1,656 | 1,8 | 2,29 |
| Tl | 1,62 | 3,24 | 1,789 | (I) 1.4 (III) 1.9 | 2,26 |
| C | 2,55 | 6,26 | 2,544 | 2,5 | 3,15 |
| Si | 1,9 | 4,77 | 1,916 | 1,9 | 2,82 |
| Ge | 2,01 | 4,57 | 1,994 | 2 | 2,79 |
| Sn | 1,96 | 4,23 | 1,824 | (II) 1.8 (IV) 2.0 | 2,68 |
| Pb | 2,33 | 3,89 | 1,854 | (II) 1.9 (IV) 2.1 | 2,62 |
| N | 3,04 | 7,23 | 3,066 | 3 | 3,56 |
| P | 2,19 | 5,62 | 2,253 | 2,1 | 3,16 |
| As | 2,18 | 5,31 | 2,211 | 2 | 3,15 |
| Sb | 2,05 | 4,85 | 1,984 | (III) 1.9 (V) 2.2 | 3,05 |
| Bi | 2,02 | 4,11 | 2,01 | (III) 1.9 (V) 2.2 | - |
| O | 3,44 | 7,54 | 3,61 | 3,55 | 3,78 |
| S | 2,58 | 6,22 | 2,589 | 2,5 | 3,44 |
| Se | 2,55 | 5,89 | 2,424 | 2,4 | 3,37 |
| Te | 2,1 | 5,49 | 2,158 | 2,1 | 3,14 |
| Po | 2 | 4,91 | 2,19 | 2 | - |
| F | 3,98 | 10,41 | 4,193 | 4 | 4 |
| Cl | 3,16 | 8,29 | 2,869 | 3 | 3,56 |
| Br | 2,96 | 7,59 | 2,685 | 2,8 | 3,45 |
| I | 2,66 | 6,76 | 2,359 | 2,5 | 3,2 |
| At | 2,2 | 5,87 | 2,39 | 2,2 | - |
| La | 1,1 | 3,06 | - | 1,2 | 2,49 |
| Ce | 1,12 | 3,05 | - | - | 2,61 |
| Pr | 1,13 | 3,21 | - | - | 2,24 |
| Nd | 1,14 | 3,72 | - | - | 2,11 |
| Pm | 1,13 | 2,86 | - | - | - |
| Sm | 1,17 | 2,9 | - | - | 1,9 |
| Eu | 1,2 | 2,89 | - | - | 1,81 |
| Gd | 1,2 | 3,14 | - | - | 2,4 |
| Tb | 1,1 | 3,51 | - | - | 2,29 |
| Dy | 1,22 | 3,15 | - | - | 2,07 |
| Ho | 1,23 | 3,18 | - | - | 2,12 |
| Er | 1,24 | 3,21 | - | - | 2,02 |
| Tm | 1,25 | 3,61 | - | - | 2,03 |
| Yb | 1,1 | 3,12 | - | - | 1,78 |
| Lu | 1,27 | 2,89 | 1,09 | - | 2,68 |
| Th | 1,3 | 3,63 | - | (IV) 1.3 | 2,62 |
| U | 1,38 | 3,36 | - | (IV) 1.4 (V) 1.6 (VI) 1.8 | 2,45 |
| He | - | 12,29 | 4,16 | - | - |
| Ne | - | 10,78 | 4,787 | - | - |
| Ar | - | 7,88 | 3,242 | - | - |
| Kr | 3,23 | 7 | 2,966 | - | - |
| Xe | 3,02 | 6,07 | 2,582 | - | - |
| Rn | 2,81 | 5,37 | 2,6 | - | - |
Строго говоря, элементу нельзя приписать постоянную электроотрицательность. Электроотрицательность атома зависит от многих факторов, в частности, от валентного состояния атома, формальной степени окисления, типа соединения, координационного числа, природы лигандов, составляющих окружение атома в молекулярной системе, и от некоторых других. В последнее время все чаще для характеристики электроотрицательности используют так называемую орбитальную электроотрицательность, зависящую от типа атомной орбитали, участвующей в образовании связи, и от её электронной заселённости, то есть от того, занята атомная орбиталь неподелённой электронной парой, однократно заселена неспаренным электроном или является вакантной. Но, несмотря на известные трудности в интерпретации и определении электроотрицательности, она всегда остаётся необходимой для качественного описания и предсказания природы связей в молекулярной системе, включая энергию связи, распределение электронного заряда и степень ионности (полярности), силовую постоянную и т. д.
В период бурного развития квантовой химии как средства описания молекулярных образований (середина и вторая половина XX века) плодотворным оказался подход Л. Полинга, который в числе прочих исследований ввёл собственную шкалу электроотрицательностей, в которой из «стандартных» элементов максимальную имеет фтор (), а минимальную — франций (). Степень ионности связи, то есть вклад структуры, при которой более электроотрицательный атом полностью «забирает» себе валентные электроны, в общую резонансную «картину», в этой теории определяется как
где — разность электроотрицательностей образующих связь атомов.
Одним из наиболее развитых в настоящее время подходов является подход Сандерсона. В основу этого подхода легла идея выравнивания электроотрицательностей атомов при образовании химической связи между ними. В многочисленных исследованиях были найдены зависимости между электроотрицательностями Сандерсона и важнейшими физико-химическими свойствами неорганических соединений подавляющего большинства элементов периодической таблицы.[9] Очень плодотворной оказалась и модификация метода Сандерсона, основанная на перераспределении электроотрицательности между атомами молекулы для органических соединений.[10][11][12]
Практическая шкала электроотрицательности атомов
Детальный поиск взаимосвязи между шкалами электроотрицательностей позволил сформировать новый подход к выбору практической шкалы электроотрицательностей атомов. В основу практической шкалы электроотрицательностей атомов взята концепция Луо-Бенсона, использующая понятие ковалентного радиуса r. По физическому смыслу электроотрицательность атома χЛБ — это величина, пропорциональная энергии притяжения валентного электрона, находящегося на расстоянии r от атомного ядра:
Где m и n — число p- и s- электронов в валентной оболочке атома.
Сами Луо и Бенсон рекомендовали для величины χ ЛБ (электроотрицательности атомов) более точное название «ковалентный потенциал». В процессе разработки практической шкалы электроотрицательностей шкала Луо и Бенсона была дополнена электроотрицательностями d- и f-элементов, для которых в расчётное управление введено число внешних электронов, равное двум. Значения электроотрицательностей атомов в практической шкале χ * и их ковалентных радиусов r (Å) приведены в таблице:
|
Приведённая в таблице совокупность значение χ* демонстрирует важную особенность практической шкалы электроотрицательностей: значение электроотрицательности для водорода в этой шкале χ*(H)=2,7 определяет чёткую границу между металлами (М) и неметаллами [Н]: χ*(М) < χ*[Н]. Исключение составляют лишь постпереходные металлы (Sn, Bi, Po), в то время как в других шкалах значения электроотрицательностей, меньшие электроотрицательности водорода, помимо металлов, имеют большинство неметаллов (B, Si, Ge, As, Sb, Te), а в шкале Парра-Пирсона даже углерод, фосфор, сера, селен, иод.[13]
Особое положение водорода в практической шкале даёт основание рассматривать электроотрицательность водорода как «меру» электроотрицательности элементов, которая позволяет осуществить переход к безразмерной практической шкале χ*, определяемой как отношение χ*(X)/ χ*(Н).[13]
Значения относительной электроотрицательности
| Группа | I A | II A | III B | IV B | V B | VI B | VII B | VIII B | VIII B | VIII B | I B | II B | III A | IV A | V A | VI A | VII A | VIII A | |
| Период | |||||||||||||||||||
| 1 | H 2,20 |
He 4,5 | |||||||||||||||||
| 2 | Li 0,99 |
Be 1,57 |
B 2,04 |
C 2,55 |
N 3,04 |
O 3,44 |
F 3,98 |
Ne 4,4 | |||||||||||
| 3 | Na 0,98 |
Mg 1,31 |
Al 1,61 |
Si 1,90 |
P 2,19 |
S 2,58 |
Cl 3,16 |
Ar 4,3 | |||||||||||
| 4 | K 0,82 |
Ca 1,00 |
Sc 1,36 |
Ti 1,54 |
V 1,63 |
Cr 1,66 |
Mn 1,55 |
Fe 1,83 |
Co 1,88 |
Ni 1,91 |
Cu 1,90 |
Zn 1,65 |
Ga 1,81 |
Ge 2,01 |
As 2,18 |
Se 2,55 |
Br 2,96 |
Kr 3,00 | |
| 5 | Rb 0,82 |
Sr 0,95 |
Y 1,22 |
Zr 1,33 |
Nb 1,6 |
Mo 2,16 |
Tc 1,9 |
Ru 2,2 |
Rh 2,28 |
Pd 2,20 |
Ag 1,93 |
Cd 1,69 |
In 1,78 |
Sn 1,96 |
Sb 2,05 |
Te 2,1 |
I 2,66 |
Xe 2,60 | |
| 6 | Cs 0,79 |
Ba 0,89 |
* |
Hf 1,3 |
Ta 1,5 |
W 2,36 |
Re 1,9 |
Os 2,2 |
Ir 2,20 |
Pt 2,28 |
Au 2,54 |
Hg 2,00 |
Tl 1,62 |
Pb 2,33 |
Bi 2,02 |
Po 2,0 |
At 2,2 |
Rn 2,2 | |
| 7 | Fr
0,7 |
Ra 0,9 |
** |
Rf |
Db |
Sg |
Bh |
Hs |
Mt |
Ds |
Rg |
Cn |
Nh |
Fl |
Mc |
Lv |
Ts |
Og | |
| Лантаноиды | * |
La 1,1 |
Ce 1,12 |
Pr 1,13 |
Nd 1,14 |
Pm 1,13 |
Sm 1,17 |
Eu 1,2 |
Gd 1,2 |
Tb 1,1 |
Dy 1,22 |
Ho 1,23 |
Er 1,24 |
Tm 1,25 |
Yb 1,1 |
Lu 1,27 | |||
| Актиноиды | ** |
Ac 1,1 |
Th 1,3 |
Pa 1,5 |
U 1,38 |
Np 1,36 |
Pu 1,28 |
Am 1,13 |
Cm 1,28 |
Bk 1,3 |
Cf 1,3 |
Es 1,3 |
Fm 1,3 |
Md 1,3 |
No 1,3 |
Lr 1,291 | |||