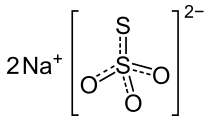
Тиосульфат натрия
Тиосульфа́т на́трия (антихлор, гипосульфит, сульфидотриоксосульфат натрия, натрий серноватистокислый) — неорганическое соединение, соль натрия и тиосерной кислоты c химической формулой Na2S2O3 или Na2SO3S, образует кристаллогидрат состава Na2S2O3·5H2O. Применяется в медицине, фотографии и других отраслях промышленности.
Что важно знать
| Тиосульфат натрия | |
|---|---|
| Общие | |
| Систематическое наименование |
тиосульфат натрия |
| Традиционные названия | гипосульфит |
| Хим. формула | Na2S2O3, Na2S2O3·5H2O (кристаллогидрат) |
| Физические свойства | |
| Молярная масса | 158,11 г/моль |
| Плотность | 2,345 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 48,5 °С (пентагидрат) |
| • разложения | 300[1] |
| Химические свойства | |
| Растворимость | |
| • в воде | 70,120; 22980 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7772-98-7 |
| 3D model (JSmol) | Интерактивная схема |
| PubChem | 24477 |
| UNII | L0IYT1O31N |
| CompTox Dashboard EPA | DTXSID9042417 |
| Рег. номер EINECS | 231-867-5 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E539 |
| RTECS | XN6476000 |
| ChEBI | 132112 |
| ChemSpider | 22885 |
| ECHA InfoCard | 100.028.970 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Историческая справка
Тиосульфат натрия был получен, вероятно, впервые в 1799 году Шоссье, нагревавшим сульфат натрия с древесным углём. В 1877 году Вагнер рекомендовал название «тиосерная» для соответствующей кислоты, после чего термин «тиосульфат натрия» почти полностью вытеснил более раннее название «гипосульфит натрия» из химической литературы[2]. Тиосульфат натрия как реагент для титрования иода предложен в 1853 году Шварцем (Karl Leonhard Heinrich Schwarz, 1824–1890)[3].
Получение
- окислением полисульфидов натрия;
- кипячение избытка серы с Na2SO3:
- взаимодействием H2S и SO2 с NaOH (побочный продукт в производстве NaHSO3, сернистых красителей, при очистке промышленных газов от S):
- кипячение избытка серы с гидроксидом натрия:
затем по приведённой выше реакции сульфит натрия присоединяет серу, образуя тиосульфат натрия.
Одновременно в ходе этой реакции образуются полисульфиды натрия (они придают раствору жёлтый цвет). Для их разрушения в раствор пропускают SO2.
- чистый безводный тиосульфат натрия можно получить реакцией серы с нитритом натрия в формамиде. Эта реакция количественно протекает (при 80 °C за 30 минут) по уравнению:
- растворение сульфида натрия в воде в присутствии кислорода воздуха:
Физические и химические свойства
Имеет вид бесцветных кристаллов. Образует три модификации: моноклинную α (a = 0,8513, b = 0,8158, c = 0,6425, β = 97,08°, z = 4, пространственная группа P21/c), а также β и γ. α-модификация переходит в β при температуре 330 °C, β переходит в γ при 380 °C. Плотность α-модификации 2,345 г/см3[4].
Хорошо растворяется в воде: 50,1 г/100 мл (0 °C), 70,2 г/100 мл (20 °C), 231,8 г/100 мл (80 °C)[4], процесс растворения эндотермический.
Молярная масса 248,17 г/моль (пентагидрат). При 48,5 °C кристаллогидрат растворяется в своей кристаллизационной воде, образуя перенасыщенный раствор; обезвоживается около 100оС.
При нагревании до 220 °C распадается по схеме:
Тиосульфат натрия — сильный восстановитель. С сильными окислителями, например, свободным хлором, окисляется до сульфатов или серной кислоты:
Более слабыми или медленно действующими окислителями, например, иодом, переводится в соли тетратионовой кислоты:
Приведённая реакция очень важна, так как служит основой иодометрии. Следует отметить, что в щелочной среде окисление тиосульфата натрия иодом может идти до сульфата.
Выделить тиосерную кислоту (тиосульфат водорода) реакцией тиосульфата натрия с сильной кислотой невозможно, так как она неустойчива и тут же разлагается на воду, серу и диоксид серы:
Применение
- для удаления следов хлора после отбеливания тканей;
- для извлечения серебра из руд;
- фиксаж в фотографии[5];
- реактив в иодометрии;
- противоядие при отравлении: As, Br, Hg и другими тяжёлыми металлами, цианидами (переводит их в роданиды) и др.;
- для дезинфекции кишечника;
- для лечения чесотки (совместно с соляной кислотой);
- противовоспалительное и противоожоговое средство;
- как среда для определения молекулярных весов по понижению точки замерзания (криоскопическая константа 4,26°);
- в пищевой промышленности зарегистрирован в качестве пищевой добавки E539;
- добавки для бетона;
- для очищения тканей от иода;
- марлевые повязки, пропитанные раствором тиосульфата натрия, использовали для защиты органов дыхания от отравляющего вещества хлора в Первую мировую войну;
- антидот при передозировке лидокаина.
- в аквариумистике для подготовки водопроводной воды к содержанию рыб (мгновенно связывает металлы и удаляет хлор)
Примечания
Литература
- Антихлор // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Петрашень В. И. Объёмный анализ. — М.—Л.: Госхимиздат, 1946. — 292 с.
- Гурлев Д. С. Справочник по фотографии (обработка фотоматериалов). — К.: Тэхника, 1988.
- Куликова Л. Н. Натрия тиосульфат // Химическая энциклопедия : в 5 т. / Гл. ред. И. Л. Кнунянц. — М.: Большая Российская энциклопедия, 1992. — Т. 3: Меди — Полимерные. — С. 186—187. — 639 с. — 48 000 экз. — ISBN 5-85270-039-8.