Пиросульфит натрия
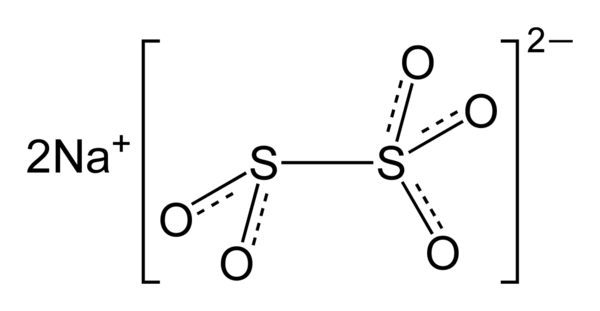
Пиросульфит натрия (Na2S2O5), или метабисульфит натрия, или натрий пиросернистокислый — соль пиросернистой кислоты, белый или желтоватый кристаллический порошок с резким запахом. Зарегистрирован в качестве пищевой добавки Е223.
Иногда называют также бисульфит натрия, дисульфит натрия, натрий пиросульфит, натрий метабисульфит.
Что важно знать
| Пиросульфит натрия | |
|---|---|
| Общие | |
| Систематическое наименование |
метабисульфит натрия |
| Сокращения | E 223 |
| Традиционные названия | пиросульфит натрия |
| Хим. формула | Na2(SO2SO3) |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 190,11 г/моль |
| Плотность | 2,36 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 150 °C |
| • разложения | 302 ± 1[1] |
| Химические свойства | |
| Растворимость | |
| • в воде | 54,0 - 65,0 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7681-57-4 |
| 3D model (JSmol) | Интерактивная схема |
| PubChem | 656671 |
| UNII | 4VON5FNS3C |
| CompTox Dashboard EPA | DTXSID0029684 |
| Рег. номер EINECS | 231-673-0 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E223 |
| RTECS | UX8225000 |
| ChEBI | 114786 |
| ChemSpider | 571015 |
| ECHA InfoCard | 100.028.794 |
| Безопасность | |
| Пиктограммы ECB |
|
| NFPA 704 | |
Химические свойства
В воде легко происходит гидролиз с превращением в гидросульфит натрия:
При нагревании соли происходит термическое разложение с выделением диоксида серы (SO2):
Производство
Пиросульфит натрия (метабисульфит натрия) получают взаимодействием сернистого ангидрида с содово-сульфитным раствором.
Применение
- Пищевая промышленность: применяется как консервант, антиоксидант, отбеливатель и разрыхлитель, используется при производстве фруктовых соков, сладостей, вина и пива;
- Фармацевтическая промышленность: применяется в качестве наполнителя в некоторых таблетках, вспомогательного вещества в инъекционных лекарственных препаратах, системах фильтрации воды, для дезинфекции оборудования.
- Химическая промышленность: используется в качестве средства для удаления пятен от ржавчины[2]; используется в качестве восстановителя для разрушения сульфидных связей в сморщенных предметах одежды из натуральных волокон, что позволяет одежде вернуться к своей первоначальной форме после стирки; используется в качестве источника SO2 (смешанного с воздухом или кислородом) для разрушения цианида в коммерческих процессах цианирования золота; используется для тонирования металлических образцов на основе железа для микроструктурного анализа[3][4];
- Сельское хозяйство: используется для удаления пней.
Токсичность и безопасность
Пиросульфит натрия является трудногорючим и взрывобезопасным веществом, по степени воздействия на организм относится к веществам 3-го класса опасности. Опасности по ГН-98 отсутствуют.
Пиросульфит натрия вреден при попадании внутрь организма и в глаза. Работать с ним нужно в очках, маске и перчатках. При попадании в глаза их необходимо промыть большим количеством воды и обратиться к врачу.
При взаимодействии с водой и кислотами или нагревании выше температуры 65 °C выделяет токсичный газ — сернистый ангидрид SO2.
Пиросульфит натрия одобрен в качестве безопасной пищевой добавки[5][6][7].
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) признаёт пиросульфит натрия как «общепризнанную безопасную» (GRAS) пищевую добавку в США, за исключением его использования в продуктах, признанных источником витамина B1 (тиамина), поскольку пиросульфит натрия (наряду с добавками Е220-Е228, выделяющими Диоксид серы) разлагает этот микронутриент и его использование в перечне богатых витамином B1 продуктов, а также фруктов и овощей запрещено[5].
Объединённый экспертный комитет ФАО/ВОЗ по пищевым добавкам (JECFA) в 1998 году установил допустимое суточное потребление (ДСП) пиросульфита натрия в количестве 0,7 мг/кг массы тела (в пересчёте с диоксида серы)[6]. В 2016 году Европейское агентство по безопасности продуктов питания (EFSA), проводя пересмотр безопасности Е223, согласилось с мнением JECFA и признало текущее ДСП безопасным для здоровья[7].
Стандарты
• Пиросульфит натрия технический. ГОСТ 11683-76[8]