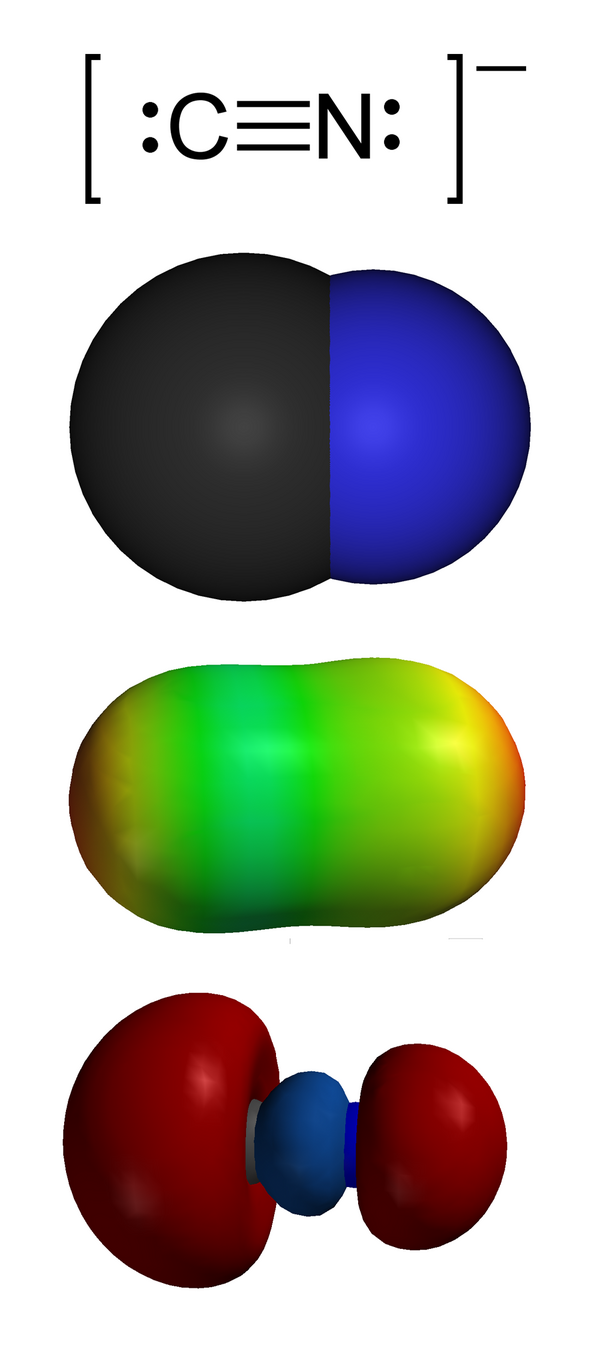Цианиды
Циани́ды — соли цианистоводородной (синильной) кислоты. В номенклатуре ИЮПАК к цианидам относят также C-производные синильной кислоты — нитрилы[1].
Получение
Основой способ получения цианидов щелочных металлов — взаимодействие соответствующего гидроксида с синильной кислотой, в частности, это основной метод получения наиболее крупнотоннажного цианида — цианида натрия. Другой промышленный метод получения цианида натрия — сплавление цианамида кальция с углём и хлоридом натрия либо содой с образованием цианплава:
Прочие цианиды получают в основном реакциями обмена цианидов щелочных металлов с соответствующими солями.
Цианиды щелочных металлов также могут быть получены взаимодействием металла с дицианом:
или из роданидов путём нагрева их в присутствии железного порошка:
Свойства
Цианиды щелочных и щёлочноземельных металлов — ионные соединения, хорошо растворимые в воде. Их водные растворы вследствие гидролиза имеют щелочную реакцию, и при использовании в промышленности в растворы цианидов щелочных металлов в качестве стабилизатора добавляют соответствующие гидроксиды. Цианиды щелочных металлов во влажном воздухе разлагаются с выделением синильной кислоты и образованием соответствующего карбоната.
При нагревании водные растворы ионных цианидов разлагаются с образованием формиата и аммиака:
Под действием мягких окислителей (в том числе и при действии кислорода воздуха) цианиды щелочных металлов легко окисляются до цианатов:
Применение
- Цианиды применяют для извлечения золота и серебра из руд методом цианирования (один из процессов гидрометаллургии, основанный на растворении металла в цианистых растворах вследствие образования комплексных солей).
- В электрохимии — как комплексообразователь с высокой константой устойчивости для составления электролитов для гальванического покрытия благородными металлами изделий (золочение, серебрение, платинирование).
- В органическом синтезе.
- Цианиды применяют в аналитической химии для разделения металлов (как комплексообразователь).
- Как и ферроцианиды, цианиды когда-то использовались для азотирования стали.
- Использовались в качестве ядов, в том числе как яд от мышей и крыс; синильная кислота и некоторые её производные (хлорциан) также применялись в качестве боевых отравляющих веществ.
- В качестве отбеливателя в мокром фотопроцессе.
Токсикология
Все (неорганические) цианиды очень ядовиты. Цианиды в XX веке применялись как отравляющее вещество против грызунов в сельском хозяйстве. В начале XX века синильная кислота использовалась французами как боевое отравляющее вещество (ОВ), как например хлорциан.
Цианид-анион является ингибитором фермента цитохром с-оксидаза (он же aa3) в IV комплексе дыхательной цепи переноса электронов (у эукариот локализована на внутренней мембране митохондрий). Связывается с железом, входящим в состав фермента, чем препятствует переносу электронов между цитохром с-оксидазой и кислородом. В результате нарушается транспорт электронов, и, следовательно, прекращается аэробный синтез АТФ.
Наиболее токсичным цианидом является синильная кислота.
Промывные воды гальванических участков, в которых используются цианиды, относительно легко обезвреживаются с помощью окислителей. В связи с этим в 80-х — 90-х гг. XX века был приостановлен массовый переход на «нецианистые электролиты» — оказалось, что несмотря на меньшую токсичность, они сложнее в обезвреживании и часто менее технологичны.
Наиболее часто применяются гипохлориты (хлорная известь, гипохлорит натрия).
При отравлении цианидами следует принять следующие меры[2]:
Противоцианидные антидоты вводят внутривенно или перорально. Их можно разделить на три основных класса. Первый — сахара (прежде всего глюкоза), необратимо связывающие цианиды в нетоксичные циангидрины. Постоянно присутствуют в крови, собственно, и обеспечивая максимальную несмертельную дозу в десятки миллиграммов.
Из второй группы можно назвать тиосульфат натрия, который реагирует с цианидами, превращая их в роданиды, которые также безвредны. Третья группа антидотов — вещества, превращающие гемоглобин крови в метгемоглобин. Он не способен переносить кислород, но быстро связывает цианиды с образованием цианметгемоглобина, который впоследствии выводится из организма. К этой группе относятся некоторые красители (например, метиленовый синий), органические и неорганические нитриты.
Метгемоглобинобразователи наиболее эффективны из всех антидотов, так как действуют быстрее других, но в то же время они и опасны сами по себе: при их передозировке кровь теряет способность переносить кислород. Кроме того, реакция образования цианметгемоглобина обратима, и со временем часть цианида будет высвобождаться обратно. Поэтому антидоты этой группы применяют обычно в сочетании с антидотами других групп.
К третьей группе относятся амилнитрит и нитроглицерин.