Пирофосфат натрия
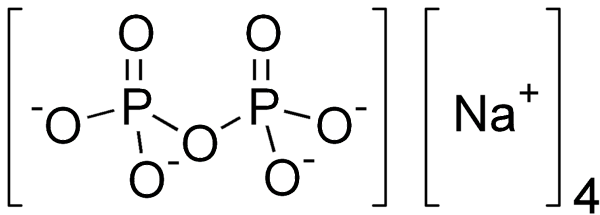
Пирофосфат натрия — неорганическое соединение, соль щелочного металла натрия и пирофосфорной кислоты с формулой Na4P2O7. Пищевая добавка зарегистрирована под кодом E450, относится к группе пищевых стабилизаторов. В свободном виде представляет собой белый порошок без вкуса и со специфическим запахом. Он состоит из аниона пирофосфата и ионов натрия. В воде образует кристаллогидраты. Токсичность примерно в два раза выше, чем у поваренной соли при пероральном приёме[2].
Что важно знать
| Пирофосфат натрия | |
|---|---|
| Общие | |
| Хим. формула | Na4Р2О7 |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 265,9 г/моль |
| Плотность | 2,45 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 890 °C |
| Давление пара | 0 ± 1[1] |
| Классификация | |
| Рег. номер CAS | 7722-88-5 |
| 3D model (JSmol) | Интерактивная схема |
| PubChem | 24403 |
| UNII | O352864B8Z |
| CompTox Dashboard EPA | DTXSID9042465 |
| Рег. номер EINECS | 231-767-1 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E450(iii) |
| RTECS | HG/T2968-1999 |
| ChEBI | 71240 |
| ChemSpider | 22813 |
| ECHA InfoCard | 100.028.880 |
Производство
Пирофосфат натрия получают в результате реакции ортофосфорной кислоты с карбонатом натрия с образованием гидрофосфата натрия, который затем нагревают до 450 °C с образованием пирофосфата натрия:
2 Na2HPO4 → Na4P2O7 + H2O
Использование
Пирофосфат натрия используется в качестве буферного агента, эмульгатора, диспергирующего агента и загустителя, а также часто используется в качестве пищевой добавки. Пирофосфат натрия добавляется во множество пищевых продуктов, включая рыбные палочки, куриные наггетсы, зефир, пудинг, крабовое мясо, консервированный тунец, альтернативы мясу на основе сои, а также в кошачий корм и кошачьи лакомства, где он используется в качестве усилителя вкусовых качеств.
В зубной пасте и зубной нити пирофосфат натрия действует как средство для борьбы с зубным камнем, удаляя кальций и магний из слюны и, таким образом, предотвращая их отложение на зубах. Пирофосфат натрия также используется в коммерческих ополаскивателях для полости рта перед чисткой щёткой, чтобы уменьшить налёт.
Пирофосфат натрия иногда используется в бытовых моющих средствах для предотвращения отложений на одежде, но из-за содержания фосфатов он вызывает эвтрофикацию воды, способствуя росту водорослей. Пирофосфат натрия также используется в механике грунтов, приводя грунт к предельной дисперсности.
Безопасность
Пирофосфат натрия считался полностью безопасной пищевой добавкой в Европейском Союзе и использовался в качестве носителя при использовании антоцианов, а также во множестве категориях продуктов питания с максимальным уровнем использования от 5000 до 12000 мг/кг продукта[3]. В 2019 году Европейское агентство по безопасности продуктов питания (EFSA) изменило дозировки пищевых добавок, являющиеся источником фосфора[4][5]. По мнению EFSA, «предполагаемое общее потребление фосфатов с пищевыми продуктами может превышать безопасный уровень ... EFSA пересмотрела допустимое суточное потребление (ДСП) для всей группы фосфатов, являющиеся источником фосфора ... Группа экспертов пришла к выводу, что, с учётом изменения уровня ДСП, потребление фосфора в размере 40 мг/кг массы тела в день из продуктов питания не оказывает вредного воздействия»[4][5].
Согласно мнению экспертов Управлению по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA), пирофосфат натрия считается «общепризнанным безопасным при использовании в соответствии с надлежащей производственной практикой»[6].
Объединённый экспертный комитет ФАО/ВОЗ по пищевым добавкам в 1982 году счёл группу фосфатов (E338–341, E343, E450–452) безопасными пищевыми добавками при условии употребления не более 70 мг/кг массы тела[7] (впоследствии, данное количество было оспорено EFSA как небезопасное[5])
Ссылки
- Пирофосфаты Архивная копия от 5 января 2011 на Wayback Machine
- Тетрапирофосфат натрия