Естественные киллеры
Есте́ственные ки́ллеры[1], также натура́льные ки́ллеры[2], NK-кле́тки[1] (англ. Natural killer cells, NK cells), — тип цитотоксических лимфоцитов, участвующих в функционировании врождённого иммунитета. Функционально NK-клетки аналогичны цитотоксическим T-лимфоцитам (T-киллерам) адаптивного иммунитета позвоночных. NK-клетки обеспечивают ответ на заражение внутриклеточными бактериями и вирусами, уничтожая инфицированные клетки, а также принимают участие в работе противоопухолевого иммунитета. В отличие от других иммунных клеток, NK-клетки распознают заражённые клетки без участия главного комплекса гистосовместимости (MHC) на их мембране, а также антител, благодаря чему ответ, опосредуемый NK-клетками, является очень быстрым[3][4].
Общая характеристика
NK-клетки являются одной из трёх линий клеток, наряду с T- и B-клетками, которые происходят от общей клетки-предшественника лимфоидных клеток. NK-клетки дифференцируются и созревают в костном мозге, лимфатических узлах, селезёнке, миндалинах и тимусе, откуда они выходят в кровоток[5]. На долю NK-клеток приходится от 5 % до 15 % мононуклеарных клеток в кровотоке и селезёнке. В других лимфоидных органах зрелых NK-клеток немного, но они в больших количествах присутствуют в печени и эндометрии матки. NK-клетки, находящиеся в кровотоке, представляют собой крупные (10—12 мкм в диаметре) лимфоциты с многочисленными азурофильными гранулами в цитоплазме. Как и другие клетки врождённого иммунитета, NK-клетки не экспрессируют многочисленные рецепторы антигенов, как T- и B-клетки. Вместо этого на поверхности NK-клеток присутствуют рецепторы, позволяющие им узнавать инфицированные клетки без участия MHC, причём гены рецепторов NK-клеток не претерпевают перестроек во время дифференцировки клеток. Среди клеток крови NK-клетки можно отличить по экспрессии гликопротеина CD56 и отсутствию маркера T-клеток CD3. У человека большая часть NK-клеток, находящихся в крови, также экспрессируют CD16, благодаря которому они распознают клетки, покрытые антителами[4][1].
Выделяют две популяции NK-клеток, которые различаются по функциям и соотношению мембранных маркеров: CD56hiCD16- и CD56loCD16+ клетки, где hi и lo обозначают высокий и низкий уровень экспрессии маркера соответственно. NK-клетки, слабо экспрессирующие CD56, преобладают в кровотоке (на их долю приходится от 90 % до 95 % NK-клеток крови), а NK-клетки с высокой экспрессией CD56 преобладают в печени, лимфатических узлах, эндометрии матки и децидуальной оболочке плода. Клетки популяции CD56loCD16+ обладают выраженной цитотоксичностью и мало секретируют цитокины, а клетки популяции CD56hiCD16-, напротив, активно секретируют интерферон γ (INF-γ) и другие цитокины[6]. Показано, что NK-клетки печени могут принимать участие в контроле фиброза печени[7][8].
Функции
Главные функции NK-клеток заключаются в уничтожении клеток, заражённых вирусами или внутриклеточными бактериями, а также в продукции INF-γ, который активирует макрофаги и запускает разрушение фагоцитированных ими клеток микроорганизмов. Механизм цитотоксичности NK-клеток напоминает таковой у T-киллеров. Как и T-киллеры, NK-клетки содержат цитоплазматические гранулы, в состав которых входят белки, убивающие клетки-мишени. При активации NK-клеток эти гранулы подвергаются экзоцитозу и высвобождают своё содержимое во внеклеточное пространство вблизи клеток-мишеней. Один из белков, входящих в гранулы NK-клеток, перфорин, облегчает вход в клетку-мишень других белков из гранул, которые называют гранзимами. Гранзимы представляют собой ферменты из группы сериновых протеаз, которые запускают в клетке-мишени каскад сигнальных путей, в конечном счёте приводящих к гибели инфицированной клетки путём апоптоза. Перфорин является аналогом терминального компонента системы комплемента C9 и полимеризуется в мембране клетки-мишени, образуя поры. Помимо перфорина и гранзимов, гранулы NK-клеток содержат амины (гистамин, серотонин), протеогликаны (хондроитинсульфат, гепарин), катехоламины (адреналин, норадреналин), ферменты (катепсины, химотрипсинподобные протеазы, кислые фосфатазы) и некоторые пептидные гормоны. В зрелых гранулах в связанной с липидами форме содержатся гранулизины[9][1].
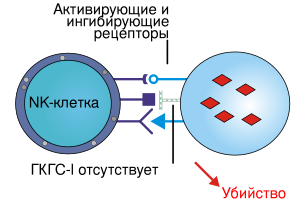
Убивая заражённые клетки, NK-клетки уничтожают резервуары инфекции в организме. На ранних стадиях вирусной инфекции происходит экспансия (размножение) NK-клеток, их активация под действием интерлейкинов IL-12 и IL-15, благодаря чему NK-клетки начинают быстро уничтожать заражённые клетки ещё до того, как активируются T-киллеры. NK-клетки также играют важную роль на поздних стадиях вирусной инфекции, убивая те заражённые клетки, которые избежали уничтожения T-киллерами, снизив экспрессию MHC I класса (MHC-I). NK-клетки могут убивать и злокачественные клетки, которые часто не экспрессируют MHC-I на достаточном уровне, чтобы быть распознанными другими лимфоцитами[9].
В процессе цитолиза, вызываемом NK-клетками, выделяют несколько стадий. На первой стадии NK-клетка распознаёт клетку-мишень и образует с ней контакт. На второй стадии NK-клетка активируется, и на третьей стадии она запускает сигнальные каскады, которые приводят к гибели клетки-мишени на четвёртой стадии. Контакт между клеткой-мишенью и NK-клеткой является иммунологическим синапсом, причём для установления контакта необходимы ионы магния. При формировании иммунологического синапса происходит взаимодействие молекул адгезии, а затем активирующих и ингибирующих рецепторов NK-клеток с их лигандами на поверхности клетки-мишени. При взаимодействии рецепторов с лигандами происходит активация NK-клеток, в результате которых содержимое гранул NK-клеток попадает в клетку-мишень. После этого этапа предотвратить апоптоз клетки-мишени уже невозможно, даже если разорвать её контакт с NK-клеткой[10].
INF-γ, продуцируемый NK-клетками, повышает способность макрофагов убивать поглощённые ими бактерии. Такую же роль выполняет и INF-γ, секретируемый T-клетками. Благодаря взаимодействию NK-клеток и макрофагов иммунной системе удаётся сдерживать инфекцию, вызванную внутриклеточной бактерией (например, Listeria monocytogenes) в течение нескольких дней или недель до того момента, пока в борьбу не включатся T-клетки. INF-γ, продуцируемый NK-клетками, находящимися в лимфоузлах, запускает дифференцировку наивных T-клеток в T-хелперы TH1. У человека некоторые NK-клетки вовсе не экспрессируют CD16 и не имеют цитотоксических свойств, однако продуцируют большое количество INF-γ. Малое количество NK-клеток повышает уязвимость организма к инфекциям, вызванным вирусами или внутриклеточными бактериями. У мышей, лишённых T-клеток, NK-клетки могут сдерживать развитие таких инфекций в течение некоторого времени, однако без T-клеток животные всё равно умирают[9].
Хотя NK-клетки принято считать компонентом врождённого иммунитета, они обладают рядом свойств, характерных для клеток адаптивного иммунитета — T- и B-клеток. Так, отдельные популяции NK-клеток могут претерпевать быструю экспансию или сокращение численности, кроме того, NK-клетки образуют особую форму иммунологической памяти, благодаря которой их ответ на повторное вторжение патогена становится более стремительным, чем при первичном контакте[11][12]. У мышей были описаны NK-клетки памяти, возникшие после заражения мышиным цитомегаловирусом, благодаря которым развивается адаптивный ответ NK-клеток[13]. NK-клетки памяти обнаруживаются в печени, селезёнке, лёгких, почках, лимфоидных органах и кровотоке[2]. У человека в случае инфекций, вызванных такими вирусами, как цитомегаловирус человека, Orthohantavirus, вирус Чикунгунья, ВИЧ, а также при вирусных гепатитах удалось продемонстрировать явление экспансии популяции NK-клеток, несущих активирующий рецептор NKG2C (KLRC2)[14]. Адаптивные NK-клетки, обладающие этим рецептором, могут использовать его непосредственно для связывания с пептидными антигенами человеческого цитомегаловируса и далее претерпевать активацию, экспансию и дифференцировку, что ранее было описано только у T-клеток[15].
Рецепторы
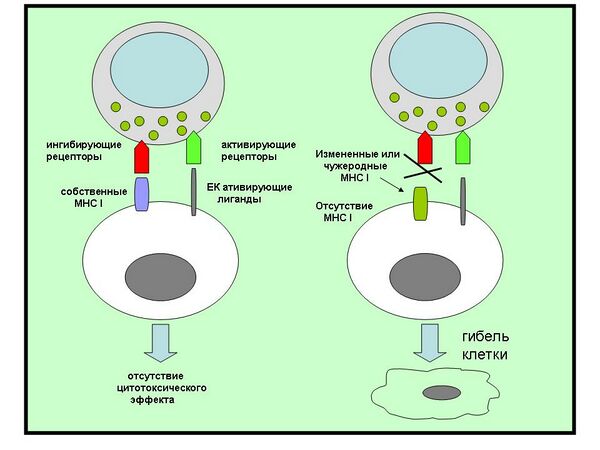
Функционирование NK-клеток регулируется балансом сигналов, поступающих от активирующих рецепторов и ингибирующих рецепторов. Эти рецепторы распознают определённые молекулы на поверхности других клеток и запускают активирующий или ингибирующий сигналы, которые активируют NK-клетки или подавляют их соответственно. Активирующие рецепторы стимулируют протеинкиназы, которые фосфорилируют дальнейших участников активирующего сигнального каскада, а ингибирующие рецепторы, напротив, запускают фосфатазы, противодействующие киназам. Активирующие рецепторы распознают лиганды на инфицированных клетках, которые необходимо уничтожить, а ингибирующие рецепторы распознают лиганды на поверхности нормальных клеток, которые не подлежат уничтожению. Конечный итог взаимодействия NK-клетки с другой клетки определяется тем, какой сигнал перевесит — активирующий или ингибирующий. Активирующие и ингибирующие рецепторы, экспрессируемые NK-клетками, весьма разнообразны даже в пределах одного организма, благодаря чему NK-клетки могут распознавать клетки, инфицированные разными патогенами. Гены, кодирующие рецепторы NK-клеток, демонстрируют выраженный полиморфизм, поэтому репертуар рецепторов в одном организме сильно отличается от такового у другого организма[9].
Цитоплазматические «хвосты» активирующих и ингибирующих рецепторов содержат структурные мотивы, которые связаны с активацией или подавлением сигнальных путей, приводящих к секреции цитокинов и активации или подавлению цитотоксичности соответственно. Активирующие рецепторы содержат мотивы, известные как ITAMs (от англ. immunoreceptor tyrosine-based activation motifs). ITAMs содержат остатки тирозина, которые фосфорилируются киназами при связывании лиганда с активирующим рецептором. Фосфорилированные ITAMs привлекают к себе другие киназы, которые благодаря этому активируются и фосфорилируют другие белки, что в конечном счёте приводит к запуску цитотоксической программы и секреции цитокинов. ITAMs содержатся в цитоплазматических «хвостах» и других рецепторов иммунных клеток. У некоторых активирующих рецепторов и внеклеточная лиганд-связывающая часть, и ITAMs входят в состав одной полипептидной цепи, а у других ITAMs входят в состав отдельной полипептидной цепи. Ингибирующие рецепторы содержат в цитоплазматической части мотивы ITIMs (от англ. immunoreceptor tyrosine-based inhibition motifs). Эти мотивы активируют молекулы, блокирующие сигнальные пути, запускаемые активирующими рецепторами. Когда ингибирующий рецептор связывается с лигандом, то остатки тирозина в составе ITIMs фосфорилируются, что активирует фосфатазы, дефосфорилирующие некоторые сигнальные белки и липиды, фосфорилированные в ходе активирующего каскада. В результате активирующий сигнал блокируется. Как и ITAMs, ITIMs, помимо ингибирующих рецепторов NK-клеток, встречаются в других рецепторах иммунных клеток[16].
Активирующие рецепторы распознают широкий спектр лигандов, некоторые из которых присутствуют и на поверхности нормальных клеток, однако большинство из них уникальны для инфицированных и злокачественных клеток. Одна из многочисленных групп активирующих рецепторов NK-клеток называется KIRs от англ. killer cell immunoglobulin-like receptors, поскольку они содержат в своём составе иммуноглобулиновый домен. Другая важная группа активирующих рецепторов относится к числу лектинов типа C и, как все лектины, обладает способностью связывать углеводные фрагменты. Некоторые активирующие рецепторы могут связываться с молекулами MHC-I, что больше свойственно ингибирующим рецепторам, и функциональное значение взаимодействия активирующих рецепторов с MHC-I неизвестно. Активирующий рецептор NKG2D связывает белки, похожие на MHC-I, которые имеются только у инфицированных и злокачественных клеток, но не нормальных клеток. Другой активирующий рецептор NK-клеток, CD16 (также известный как FcγRIIIA), обладает слабым сродством к антителам класса IgG. Благодаря этому рецептору NK-клетки могут взаимодействовать с клетками, покрытыми антителами (этот путь действия NK-клеток называют цитотоксичностью, опосредованной антителами)[17].
Большинство NK-клеток экспрессируют ингибирующие рецепторы, которые распознают молекулы MHC-I, присутствующие на поверхности всех нормальных здоровых клеток, имеющих ядро. Чаще всего клетки, инфицированные вирусами или внутриклеточными патогенами, перестают экспрессировать MHC-I. Рецепторы NK-клеток, распознающие MHC-I, фундаментально отличаются от T-клеточных рецепторов, взаимодействующих с MHC-I. Самые многочисленные ингибирующие рецепторы NK-клеток относятся к группе KIRs и распознают широкий спектр молекул MHC I класса. Многие ингибирующие рецепторы являются лектинами (например, гетеродимерный рецептор CD94/NKG2A). Третьим по многочисленности семейством ингибирующих рецепторов NK-клеток является LIRs (от англ. leucocyte immunoglobulin-like receptors). Эти рецепторы, как и KIRs, имеют иммуноглобулиновый домен и связываются с молекулами MHC-I, но с меньшим сродством, чем KIRs. LIRs больше экспрессируются B-клетками, чем NK-клетками[18].
История изучения
NK-клетки стали первыми описанными и наиболее хорошо изученными лимфоидными клетками врождённого иммунитета. Открытие уникальной группы лимфоцитов, имеющих «естественную» или «спонтанную» цитотоксичность (отсюда название «естественные киллеры»), у мышей было сделано Рольфом Кисслингом (англ. Rolf Kiessling и Хью Проссом (англ. Hugh Pross) в 1975 году[19], а у человека их открыли Хью Просс и Майкл Джондал (англ. Mikael Jondal) в том же году[20][21]. В 1980 году NK-клетки удалось изолировать с помощью градиентного центрифугирования и впервые изучить с помощью микроскопии[22].
Клиническое значение
NK-клетки являются привлекательными объектами для использования в иммунотерапии рака. Некоторые особенности NK-клеток делают их более перспективными в иммунотерапии онкологических заболеваний по сравнению с T-клетками. При введении NK-клеток почти исключается развитие реакции «трансплантант против хозяина», кроме того, NK-клетки практически не оказывают цитотоксического действия на нормальные клетки, что снижает вероятность побочных эффектов иммунотерапии. Однако получить NK-клетки в достаточном для терапии количестве очень сложно, что значительно затрудняет их применение в медицинских целях[2].
Примечания
Литература
- Ярилин А. А. Иммунология. — М.: ГЭОТАР-Медиа, 2010. — 752 с. — ISBN 978-5-9704-1319-7.
- Abul K. Abbas, Andrew H. Lichtman, Shiv Pillai. Cellular and Molecular Immunology (англ.). — Philadelphia: Elsevier Saunders, 2015. — ISBN 978-0-323-22275-4.