Главный комплекс гистосовместимости
Главный комплекс гистосовместимости (ГКГС, или ГКГ, англ. MHC, major histocompatibility complex) — большая область генома или большое семейство генов, обнаруженное у позвоночных и играющее важную роль в иммунной системе и развитии иммунитета. Название «комплекс гистосовместимости» эта область получила потому, что обнаружена она была при исследовании отторжения чужеродных тканей. Изучение свойств и функций продуктов генов МНС показало, что отторжение трансплантата организмом при несовпадении их МНС является экспериментальным артефактом, маскирующим истинную функцию МНС — презентацию антигена лимфоцитам для распознавания и удаления собственных измененных клеток.
Эволюционно МНС возник 450 миллионов лет назад вместе с появлением челюстноротых рыб (лат. Gnathostomata). Если у бесчелюстных приобретенный иммунитет основан на вариабельных лимфоцитарных рецепторах (VLR), Т-подобных и В-подобных рецепторах, то у челюстноротых появились иммуноглобулины (Ig), Т-клеточные рецепторы (TCR) и МНС[1].
История
Первое описание МНС было сделано в середине XX века. В частности, Георгом Снеллом была обнаружена на 17-ой хромосоме мышей большая группа генов, кодирующих белки, определяющие совместимость тканей и органов при их пересадке, что позволило объяснить отторжение пересаженной кожи если донор и реципиент имеют разные варианты (аллели) МНС. Вскоре такие же гены были найдены Жаном Доссе у людей, он же вскоре описал первый лейкоцитарный антиген человека, молекулу белка, которую мы сейчас называем HLA-A2[2]. Позднее Барух Бенасерраф продемонстрировал на морских свинках, что гены МНС не только определяют индивидуальность организма, но модулируют иммунный ответ. За эти исследования в 1980 году этим трем ученым была присуждена Нобелевская премия по Медицине и Физиологии «за открытие генетически определенных структур на поверхности клеток, определяющих иммунную реакцию».
В 1974 году Рольф Зинкернагель и Дохерти, Питер продемонстрировали, что цитолитический Т-лимфоцит распознает комбинацию вируса и МНС класс I молекулы хозяина, тот же самый лимфоцит не распознает клетку, зараженную тем же вирусом, если она имеет другой аллель полиморфной МНС-I[3]. За эту работу Нобелевский комитет присудил Зинкернагелю и Дохерти Нобелевскую премию по Физиологии и Медицине в 1996 году. Через 10 лет после публикации Зинкернагеля и Дохерти стало ясно, что Т-клеткам нужен не весь вирус, даже не весь вирусный белок, антигеном является маленький пептид, получаемый при протеазном расщеплении вирусного белка[4]. И через два года после этого постдок Дона Уайли Памела Бьоркман определила первую трехмерную структуру молекулы HLA-A2[5].
Гены
Главный комплекс гистосовместимости является регионом с одной из самых высоких плотностей локализации генов. У человека 1 ген приходится на 18000 пар нуклеотидов[6]. Но еще плотнее расположены МНС гены у птиц. У курицы средний размер интронов в МНС-локусе составляет 200 оснований, а расстояние между генами, включая промоторы, может быть всего 30 оснований, что приводит к среднему размеру гена кур в три раза меньше, чем размер аналогичных генов млекопитающих[7].
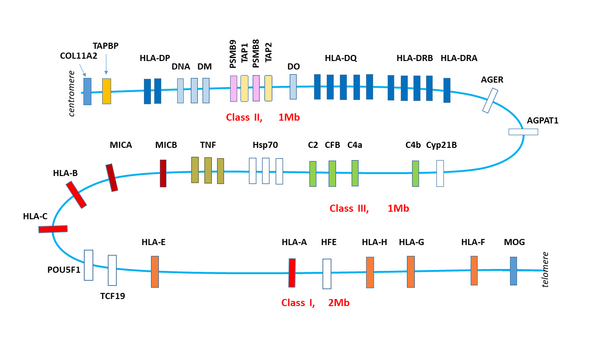
У человека область МНС исторически называется Человеческий лейкоцитарный антиген (англ. HLA, Human Leucocyte Antigen), поскольку открыта она была при изучении различий клеток белой крови у разных людей, у свиней она носит название SLA (Swine Leucocyte Antigen), у собак DLA, у коров BoLA, у мышей — область H-2, у крыс — RT1, у кур — В и т. д.. У разных организмов они находятся на разных хромосомах, имеют разную длину и включают разное число генов, но общее устройство у всех похоже. Самая изученная МНС область — человеческая HLA находится на коротком плече хромосомы 6 между генетическими маркерами MOG и COL11A2 и составляет около 4 млн пар нуклеотидов (6р21.1-21.3). HLA содержит более 200 генов, многие из которых чрезвычайно полиморфны. Не все эти гены связаны с иммунитетом, у человека лишь 40 % генов HLA кодируют белки, вовлеченные в иммунный ответ[6]. И наоборот, есть много белков иммунной системы, чьи гены расположены на других хромосомах, например, гены Т-клеточного рецептора находятся на хромосоме 14, гены интерферонов на хромосомах 9 и 12 и т. д.
В HLA выделяют три подобласти; если считать от теломеры, то сначала идет область, называемая класс I, затем класс III и класс II. У других организмов последовательность классов может быть другой. У рыб класс II вообще находится на другой хромосоме.[8]
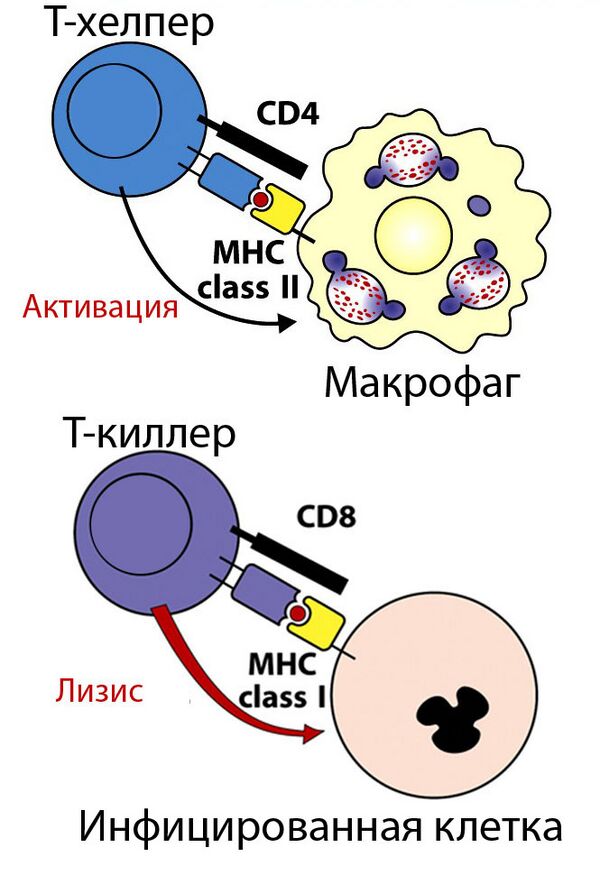
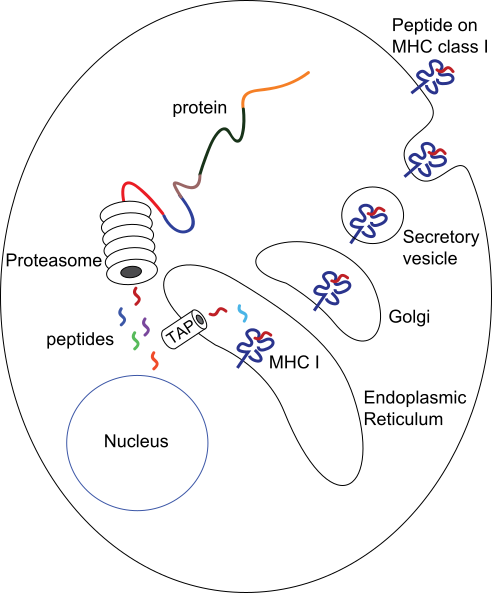
Два набора генов, класса I и II, кодирующие так называемые MHC класс I и MHC класс II молекулы, являются центральными игроками клеточного иммунитета. Основная функция МНС-I и МНС-II молекул — связывание пептидных фрагментов, полученных при внутриклеточном расщеплении белковых молекул, и презентация этих пептидов на поверхности клеток для распознавания Т- и NK- клеточными рецепторами. В большинстве своем это пептиды собственных белков, если же в организм попал патоген, то на поверхности клеток будут присутствовать и пептиды из чужих белков. Несмотря на то, что доля чужих пептидов на клеточной поверхности очень мала (одна молекула на десятки и сотни тысяч своих пептидов), такие зараженные клетки быстро распознаются Т-лимфоцитами и разрушаются иммунной системой. Презентация собственных белков на поверхности клеток чрезвычайно важна, иммунная система постоянно отслеживает и уничтожает не только инфицированные, но и поврежденные или измененные клетки[9][10].
Два свойства белков МНС являются очень важными при использования их в приобретенном иммунитете. Во-первых, полигенность: каждый организм имеет несколько генов МНС. Так, например, у каждого человека есть три гена комплекса МНС-I, HLA-А, HLA-В и HLA-С. Во-вторых, полиморфность — в популяции существует множество вариантов каждого гена, так для HLA-А на 2020 год известно 5907 аллелей, кодирующих 3702 разных белковых молекул. Просмотреть все описанные варианты молекул HLA можно в базе данных IMGT (www.imgt.org).
Наряду с классическими молекулами МНС-I, HLA-А, HLA-В и HLA-С в области класс I есть гены так называемых неклассических комплексов HLA: MICA, MICB, [[]], HLA-F и HLA-G, отличающихся от классических меньшей полиморфностью и меньшим уровнем экспрессии. MICA (MHC class I polypeptide-related sequence A) кодирует мембранно-связанный гликопротеин, чья экспрессия вызывается стрессом — температурой, вирусной или бактериальной инфекцией, онкогенной трансформацией и пр.[11] MICA является самым полиморфным из неклассических HLA, у человека описано более 150 вариантов (IMGT). MICA является лигандом рецептора CD94/NKG2D, который экспрессируется на NK-клетках и некоторых Т-лимфоцитах. При связывании с MICA CD94/NKG2D активирует цитолитическую активность этих клеток. Таким образом, MICA является сигналом иммунной системе на раннюю реакцию в ответ на инфекцию или спонтанное возникновение модифицированных раковых клеток. HLA-Е связывает обычно сигнальные пептиды классических HLA-А, В и С и служит лигандом NK-клеточных рецепторов CD94/NKG2A или CD94/NKG2B, ингибируя их цитотоксическую активность[12]. HLA-G экспрессируется только на зародышевых клетках плаценты, играя важную роль в иммунотолерантности при беременности[13].
В отличие от комплексов МНС-I, белки МНС-II экспрессируются исключительно в так называемых профессиональных антиген-презентирующих клетках (АРС). К ним относятся дендритные клетки, В-клетки и макрофаги. МНС-II — гетеродимеры, гены обеих цепей принадлежат МНС локусу. Шесть генов человеческих МНС-II носят названия HLA-DRA (B), HLA-DQA (B) и HLA-DPA (B).
Кроме МНС-I и МНС-II в этом же локусе расположены гены других белков, участвующих в презентации антигена. Два гена каталитической β-субъединицы протеосомы, PSMB8 и PSMB9 начинают экспрессироваться только в том случае, если клетка получила сигнал о наличии в среде гамма-интерферона. Замена каталитических субъединиц превращает протеосому в иммунопротеосому с измененной протеолитической специфичностью. Иммунопротеосома выпускает пептиды с гидрофобной или основной аминокислотой на С-конце, имеющие большее сродство к МНС- I[14].
Рядом с PSMB8 и PSMB9 находятся гены ТАР1 и ТАР2, кодирующие два субъединицы транспортера пептидов через мембрану эндоплазматического о. ТАР1 и ТАР2 не только переносят пептиды в ЭР, но и помогают им связаться с МНС-I. В этом им помогает тапазин, чей ген ТАРВР тоже находится в области класс II геномного локуса HLA.
Пептиды комплекса МНС-II получаются из лизосомального, а не протеосомного расщепления. Ген HLA-DM кодирует белок DM, который катализирует связывание пептидов с МНС-II. Рядом находится HLA-DО, ген отрицательного регулятора HLA-DM.
Локус HLA содержит также гены трех цитокинов семейства фактора некроза опухоли, TNF, гены белков системы комплемента (С2, С4а, С4b, CFВ) и много других генов, чьи продукты не связаны напрямую с иммунной системой, например, CYP21P — один из цитохромов Р450, POU5F1 и TCF19 — факторы транскрипции, AGER — регулятор многих клеточных процессов, Hsp70 и т. д.
Описание МНС человека с полным секвенированием и аннотацией генов было опубликовано в 1999 году в журнале Nature центрами секвенирования Великобритании, США и Японии[6]. Представленная последовательность называлась виртуальной МНС, поскольку это была мозаика, составленная из кусков генома людей с разными гаплотипами.
В том же номере журнала Nature было опубликовано описание куриной МНС, которая в 20 раз короче человеческой и включает только 19 генов[7]. В-локус кур имеет все признаки МНС: там расположены гены классических МНС- I и МНС-II молекул, он определяет тканевую специфичность и иммунный ответ. МНС-локус кур гораздо компактнее человеческого, центральная его область от гена класс II до гена класс I молекул имеет всего 44 000 оснований, хотя содержит 11 генов. Порядок генов другой, класс I и класс II области не разделены длинной класс III областью. Почти все гены В-локуса кур имеют ортологов у млекопитающих, но много генов, имеющихся в МНС областях млекопитающих, отсутствуют у кур. В В-области кур есть всего два гена молекул МНС-I и МНС-II, отсутствуют DN и DOB, нет генов каталитических субъединиц протеасом, ген неполиморфной субъединицы МНС- II, class IIa находится вне В-локуса. Зато присутствуют гены лектина и NK-рецептора, которые у млекопитающих находятся на другой хромосоме.
Секвенирование МНС локуса перепелов[8] показало похожую, но более сложную организацию из-за нескольких дупликаций. Так у перепелов есть семь генов молекул МНС класс I, семь генов b-цепи МНС класс II и 8 BG-подобных генов.
Секвенированы МНС-локусы нескольких рыб[8]. У всех у них класс II и класс I области не связаны между собой и находятся на разных хромосомах. В отличие от птиц, рыбы, как и млекопитающие, имеют в МНС области гены каталитических субъединиц протеасом, но они расположены в области класс I, вместе с генами транспортера ТАР, ТАРВР. Количество генов классических МНС у разных рыб разное, например, у фугу девять генов молекул МНС класс I, а у данио их только три.
База данных IMGT (International Immunogenetics information system) содержит информацию о нуклеотидных последовательностях MHC локусов 77 разных видов (2019-12-19).
Белки
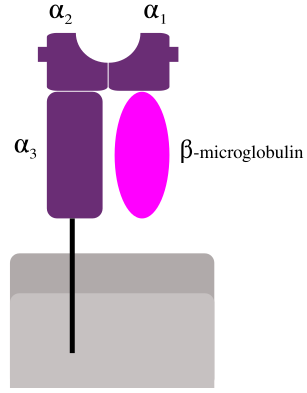
Белковая молекула МНС-I — гетеродимер, состоящий из инвариантной малой субъединицы, называемой β2-микроглобулин, и тяжелой полиморфной α-субъединицы, кодируемой одним из генов класса I локуса МНС (у человека — HLA-A, HLA-B или HLA-C). α-цепь МНС-I содержит 365 аминокислот. 284 N-концевых остатка образуют экстра-клеточную часть молекулы, следующая за ними трансмембранная спираль удерживают МНС-I на поверхности клетки, а последние 32 аминокислоты, расположенные в цитозоле, отвечают за внутриклеточный транспорт МНС-I из эндоплазматического ретикулума на поверхность[15] . Кристаллографический анализ показал, что внеклeточная область α-цепи МНС-I делится на три домена α1, α2 и α3, каждый по 90 аминокислот. α1 и α2 домены образуют антиген-связывающую часть МНС-I[5]. Антигеном для МНС-I являются пептиды длиной 8-10 аминокислот. α3 домен имеет иммуноглобулиновую укладку, такую же как соседний β2-микроглобулин, эти два иммуноглобулиновых домена отделяют пептид-связывающую область от клеточной мембраны. α1 и α2 домены имеют одинаковую третичную структуру из четырех антипараллельных β-стрендов и длинной α-спирали, лежащей сверху. Вся α1 — α2 конструкция напоминает плоскодонку, дно которой образовано восемью β-стрендами, а борта α-спиралями. Внутри этой плоскодонки размещается пептид, напоминая команду гребцов из 8-10 участников. Пептид имеет протяженную конформацию, так что в отличие от команды гребцов, боковые цепи соседних аминокислот будут направлены в разные стороны. Часть из них будет направлена вниз, связываясь в карманах дна пептидо-связывающего желоба МНС-I. Разные МНС-I имеют разные карманы, определяя пептидную специфичность каждого аллеля[16]. Например, HLA-A2 имеет небольшие гидрофобные карманы для остатков 2 и 9, и положительно-заряженный карман для остатка 4, поэтому HLA-A2 связывает пептиды, имеющие Leu/Met в положении 2, Asp/Glu в положении 4 и Val/Leu в положении 9. А вот аллель HLA-B27 связывает пептиды с Arg на втором месте, Phe/Trp/Tyr на третьем и Leu/Phe на девятом. Посмотреть мотивы пептидов для разных аллелей можно на сервере MHCMotifViewer. Остатки пептида, смотрящие вверх, будут взаимодействовать с Т-клеточным рецептором, как и несколько остатков самой МНС, опреляя двойную специфичность этого рецептора, патогенного пептида и данного аллеля МНС хозяина.
Если карманы определяют специфичность пептида, то главную роль в его связывании с МНС-I играет основная цепь, включая N- и C-концы, которые у 99 % пептидов погружены в дно желоба и закрыты остатками спиралей от окружения. Поэтому длинные пептиды обычно имеют выпячивание в центре, так как их концы удерживаются в том же месте, что и у более коротких пептидов[17].
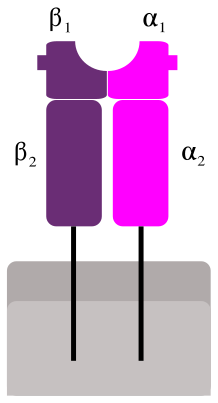
МНС-II молекулы имеют точно такую же доменную организацию, как и МНС-I, но их четыре домена расположены на двух полиморфных субъединицах примерно одинакового размера. Как α-, так и β-субъединицы имеют α1 (или β1) домен, образующий половину антиген-связывающего участка и иммуноглобулиновый домен α2 (β2), расположенный ближе к клеточной мембране[18]. Обе цепи имеют трансмембранную спираль и короткий цитоплазматический конец в 12-18 аминокислот. Трехмерная структура внеклеточных частей МНС обоих классов очень похожа, пептид также связывается в желобе между двумя спиралями. Основное отличие состоит в том, что спирали, образующие стенки антиген-связывающего желоба МНС-II, не подходят близко друг к другу, и желоб оказывается открыт с обоих концов. По этой причине, ни N-, ни C-концы пептида не принимают особого участия в связывании с МНС-II, более того, часто наблюдают, что они свешиваются наружу[19], что хорошо коррелирует с тем фактом, что антигены МНС-II гораздо длиннее, чем у МНС-I.
ГКГ и выбор сексуального партнёра
Ряд независимых исследований 1970—1990-х гг. показали, что на выбор полового партнёра влияет главный комплекс гистосовместимости. Эксперименты, проведенные первоначально на мышах и рыбах[20], затем на добровольных участниках-людях, показали, что женщины имели склонность выбирать партнёров с ГКГ, отличным от собственного, однако их выбор менялся на противоположный в случае использования гормональных оральных контрацептивов — в этом случае женщины скорее выбирали партнёра с подобным ГКГ[21][22][23].
Примечания
Литература
- Мейл, Д. Иммунология / Д. Мейл, Дж. Бростофф, Д. Б. Рот, А. Ройтт / Пер. с англ. — М.: Логосфера, 2007. — 568 с.
- Койко, Р. Иммунология / Р. Койко, Д. Саншайн, Э. Бенджамини; пер. с англ. А. В. Камаева, А. Ю. Кузнецовой под ред. Н. Б. Серебряной. -М: Издательский центр «Академия», 2008. — 368 с.