Энтальпия
Энтальпи́я (от др.-греч. ενθαλπω — «нагреваю», также теплова́я фу́нкция[1][2], теплова́я фу́нкция Гиббса[3], теплосодержа́ние[1][3] и изобарно-изоэнтропийный потенциал[4]) — функция состояния термодинамической системы, определяемая как сумма внутренней энергии и произведения давления на объём [1][5][6][K 1]:
(Определение энтальпии)
Из уравнения для дифференциала внутренней энергии[9][10]:
(Дифференциал внутренней энергии)
где — термодинамическая температура, а — энтропия, следует выражение для дифференциала энтальпии[3][11][K 2]:
(Дифференциал энтальпии)
которое является полным дифференциалом функции [K 3]. Она представляет собой термодинамический потенциал относительно естественных независимых переменных — энтропии, давления и, возможно, числа частиц и других переменных состояния .
Понятие энтальпии существенно дополняет математический аппарат термодинамики и гидродинамики. Важно, что в изобарном процессе при постоянном изменение энтальпии
равное сумме изменения внутренней энергии и совершённой системой работы , в силу первого начала термодинамики равно количеству теплоты , сообщённой системе. Это свойство энтальпии позволяет использовать её для вычисления тепловыделения при различных изобарных процессах, например, химических.
Отношение малого количества теплоты, переданного системе в изобарном процессе, к изменению температуры является теплоёмкостью при постоянном давлении[K 4][20]:
Это экспериментально измеримая величина, и из её измерений находят температурную зависимость энтальпии.
Энтальпия — экстенсивная величина: для составной системы она равна сумме энтальпий её независимых частей. Как и внутренняя энергия, энтальпия определяется с точностью до произвольного постоянного слагаемого.
Что важно знать
| Энтальпия | |
|---|---|
| Размерность | |
| Единицы измерения | |
| СИ | Дж |
| СГС | эрг |
| Примечания | |
| Внесистемные единицы: калория, британская тепловая единица | |
| Удельная энтальпия | |
|---|---|
| Размерность | |
| Единицы измерения | |
| СИ | Дж/кг |
| СГС | эрг/г |
| Примечания | |
| Внесистемные единицы: кал/г, кал/кг | |
| Молярная (мольная) энтальпия | |
|---|---|
| Размерность | |
| Единицы измерения | |
| СИ | Дж/моль (кг/моль) |
| СГС | эрг/моль (1 г/моль) |
| Примечания | |
| Внесистемная единица: кал/моль | |
| Плотность энтальпии | |
|---|---|
| Размерность | |
| Единицы измерения | |
| СИ | Дж/м3 |
| СГС | эрг/см3 |
| Полная энтальпия (удельная) (энтальпия торможения) | |
|---|---|
| Размерность | |
| Единицы измерения | |
| СИ | Дж/кг |
| СГС | эрг/г |
| Примечания | |
| Зависит от выбора системы отсчёта | |
| Полная энтальпия (инвариантная релятивистская) | |
|---|---|
| Размерность | |
| Единицы измерения | |
| СИ | Дж |
| СГС | эрг |
| Примечания | |
| Лоренц-инвариант | |
| Полная энтальпия (релятивистская) | |
|---|---|
| Размерность | |
| Единицы измерения | |
| СИ | Дж |
| СГС | эрг |
| Примечания | |
| Образует 4-вектор вместе с импульсом | |
История вопроса
Понятие энтальпии было введено и развито Дж. В. Гиббсом[22][23][24] в 1875 году в классической работе «О равновесии гетерогенных веществ». Для обозначения этого понятия Гиббс использовал термин «тепловая функция при постоянном давлении»[25][26].
Автором термина «энтальпия» в его современном значении считают Х. Камерлинг-Оннеса. Впервые о его авторстве упоминает работа 1909 года[27][28] в связи с обсуждением сохранения энтальпии в эффекте Джоуля — Томсона, хотя в печатных публикациях самого Камерлинг-Оннеса это слово не встречается[29]. Что же касается буквенного обозначения , до 1920-х годов оно использовалось для количества теплоты вообще. Определение физической величины строго как энтальпии или «теплосодержания при постоянном давлении» было официально предложено Альфредом У. Портером в 1922 году[23].
Энтальпия как термодинамический потенциал
Поскольку внутренняя энергия является термодинамическим потенциалом относительно энтропии и объёма[30], определение энтальпии можно рассматривать как преобразование Лежандра для перехода от потенциала относительно переменных к таковому относительно переменных Как и для любого термодинамического потенциала, естественные независимые переменные совокупно с производными энтальпии по этим переменным позволяют выразить любой термодинамический параметр системы, поэтому задание термодинамического потенциала является самым общим способом задания уравнения состояния[31].
Из выражения для дифференциала энтальпии получаются ещё два уравнения состояния, непосредственно выражающие температуру и объём через энтальпию и давление[32]:
Если известна энтальпия, другие термодинамические потенциалы — внутренняя энергия , свободная энергия Гельмгольца и энергия Гиббса — могут быть получены с помощью преобразования Лежандра:
Из равных друг другу смешанных производных энтальпии выводятся две термодинамические производные, связанные третьим соотношением Максвелла[33]:
Через вторые производные энтальпии выражаются ещё две термодинамические производные:
Первая из этих производных характеризует теплоёмкость при постоянном давлении вторая — адиабатическую сжимаемость. Метод якобианов позволяет получить тождества, аналогичные соотношениям Бриджмена, для выражения любых термодинамических производных через приведённые производные энтальпии.
Для состоящей из одинаковых частиц открытой системы число частиц может быть переменным[K 5]. В этом случае выражения для дифференциалов внутренней энергии и энтальпии обобщаются следующим образом[35][36]:
где — химический потенциал, который равен энергии Гиббса [37], приходящейся на одну частицу[38]: . Если частицы не рождаются и не уничтожаются в рассматриваемом процессе, можно характеризовать их количество, например, (переменной) массой тела и химический потенциал также относить к единице массы. В этом случае вклад от изменения массы вещества в дифференциалы энергии и энтальпии описывается членом , где модифицированный химический потенциал равен удельной (отнесённой к единице массы) энергии Гиббса: .
В англоязычной литературе, особенно технической, понятие открытой системы обычно отождествляют с понятием «контрольного объёма» (англ. control volume)[39], который ограничен воображаемой неподвижной контрольной[40] поверхностью, проницаемой для вещества, но оставляющей неизменной заключённый в ней объём. В то же время закрытую систему называют «контрольной массой» (англ. control mass). Последнее название подчёркивает постоянство массы (), вследствие которого справедливо приведённое выше соотношение для дифференциала внутренней энергии и термодинамическое состояние системы характеризуется только двумя параметрами, например, и . С другой стороны, при постоянстве контрольного объёма () заключённая в нём внутренняя энергия тоже характеризуется только двумя параметрами, например, энтропией и переменной массой , причём в практически важное выражение для дифференциала внутренней энергии контрольного объёма входит (удельная) энтальпия[41]:
Энергия контрольного объёма)
Если в системе присутствуют несколько различных веществ характеризующихся массами и химическими потенциалами , выражение для дифференциала энтальпии обобщается следующим образом[42][43]:
Удельная энтальпия
Вместо экстенсивной величины энтальпии часто используют её отношение её величины к массе тела , называемое удельной энтальпией. Продолжая обозначать экстенсивные величины заглавными буквами, соответствующие им удельные величины будем обозначать строчными, за исключением удельного объёма, вместо которого введём обратную к этой величине плотность:
Соотношение для полного дифференциала удельной энтальпии можно получить, разделив уравнение для дифференциала энтальпии на :
(Дифференциал удельной энтальпии)
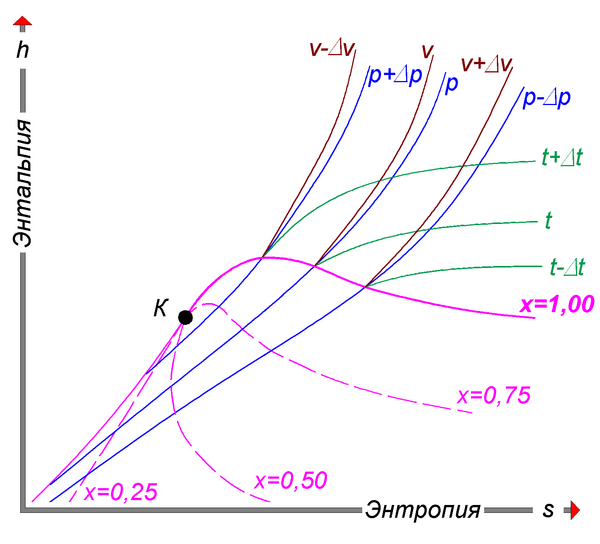
Удельную энтальпию можно представлять графически в виде -диаграммы Молье. На диаграмме кривые (изобары) для различных значений давления задают функцию [44]. Большой практический интерес представляет диаграмма Молье для воды/водяного пара[45], схематически изображённая на рисунке: синие линии — изобары, зелёные — изотермы. Область ниже красной кривой соответствует двухфазной среде пара и воды. В этой области красные линии соответствуют различным значениям величины — массовой доли водяного пара — и пересекаются в критической точке K, а изобары совпадают с изотермами и являются прямыми линиями.
Вводят также молярную (мольную) энтальпию , отнесённую не к массе, а к количеству вещества в теле в молях n, что удобно для приложений к химии. Молярные величины обозначают нижним индексом m. Альтернативное определение через удельную энтальпию: , где — относительная молекулярная масса, а кг/моль =1 г/моль — коэффициент для перевода относительной молекулярной массы в молярную[46].
Плотности внутренней энергии и энтальпии (на единицу объёма) вводят как отношение этих величин к объёму. Отдельные обозначения для этих величин здесь не вводятся, их можно выразить через удельные величины и массовую плотность:
Деление уравнения для дифференциала энергии контрольного объёма на величину контрольного объёма даёт соотношение[47]:
(Дифференциал плотности энергии)
Для идеального газа с постоянной теплоёмкостью плотность внутренней энергии и энтальпии простым образом выражается через давление[48]:
где — показатель адиабаты, равный для одноатомного газа, для фотонного газа (излучения чёрного тела)[49].
Энтальпия сложных термодинамических систем
Для термодинамических систем сложного типа, в которых термодинамическая работа[50] не сводится к работе внешних сил давления , первое начало термодинамики, а значит и выражение для дифференциала внутренней энергии, включают вклад от термодинамической работы в виде[35][51]:
где — -я обобщённая сила и — сопряжённая с ней -я обобщённая координата, во втором равенстве из общего перечня переменных выделена обобщённая сила и обобщённая координата . Для этого случая определение обобщённой энтальпии [52] даёт[53]:
Обобщённая энтальпии сохраняет смысл эквивалента теплоты для изобарного процесса[54][55], если не только давление, но и все остальные обобщённые силы поддерживаются постоянными: .
Энтальпия образования
Для приложений к химии в общем случае открытых систем для полного дифференциала энтальпии получаем:
Выражение для заимствуем из дифференциальной версии фундаментального уравнения Гиббса для внутренней энергии открытой термодинамической системы[56][57]:
где — масса -го независимого компонента[K 6], — химический потенциал этого компонента. Запишем уравнение Гиббса в следующем виде:
Подставив это выражение в соотношение (***), получаем дифференциальную версию фундаментального уравнения Гиббса для энтальпии:
Все химические реакции сопровождаются выделением (экзотермические) или поглощением (эндотермические) тепла. Одно из приложений энтальпии основано на том, что множество химических процессов в реальных или лабораторных условиях реализуются именно при постоянном (атмосферном) давлении. Поэтому мерой теплового эффекта реакции служит изменение энтальпии ΔН в ходе химической реакции, в результате которой исходные вещества исчезают и образуются продукты реакции. В случае экзотермических реакций система теряет тепло и ΔН — величина отрицательная. В случае эндотермических реакций система поглощает тепло и ΔН — величина положительная. В частности, энтальпия образования — это количество теплоты, которое поглощается (если энтальпия образования положительна) или выделяется (если энтальпия образования отрицательна) при образовании сложного вещества из простых веществ.
Значение энтальпии образования и другие термодинамические свойства веществ приведены в справочниках[58][59].
Зависимость энтальпии от температуры
Во многих приложениях (но только не в качестве термодинамического потенциала!) энтальпию системы удобно представлять в виде функции от давления и температуры . Чтобы получить выражение для дифференциала энтальпии в переменных дифференциал энтропии выражается через :
Температурная производная энтропии выражается через (измеримую) теплоёмкость при постоянном давлении . Производная энтропии по давлению выражаются с помощью четвёртого соотношения Максвелла (G2) что даёт и:
Для идеального газа в силу закона Гей-Люссака так что выражение в квадратных скобках равно нулю, и энтальпия идеального газа зависит только от температуры. Если к тому же идеальный газ имеет постоянную темплоёмкость, его энтальпия линейно зависит от температуры[60]:
(Энтальпия идеального газа)
где — внутренняя энергия молекулы при нулевой температуре[K 7], — масса молекулы. Удельная энтальпии выражена через удельную теплоёмкость отнесённую к единице массы.
Для реальных систем изменение энтальпии при изменении температуры в изобарическом процессе практически удобно рассчитывать, если известна теплоёмкость при постоянном давлении (например, в виде ряда по степеням с эмпирическими коэффициентами[61][62]):
Поскольку разности энтальпий продуктов химической реакции и исходных веществ определяет тепловой эффект химической реакции, разность теплоёмкостей продуктов реакции и исходных веществ определяет зависимость теплового эффекта реакции от температуры (термохимический закон Кирхгофа).
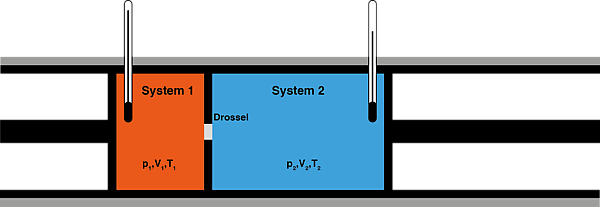
Сохранение энтальпии в процессе Джоуля — Томсона привлекается для количественного описания эффекта. Схема процесса представлена на рисунке 2. Левый поршень, вытесняя газ под давлением из объёма , совершает над ним работу . Пройдя через дроссель и расширяясь в объём , газ совершает работу над правым поршнем. Суммарная работа , совершенная над газом, равна изменению его внутренней энергии , так что энтальпия сохраняется: [63][64]
Из уравнения для дифференциала энтальпии выводится выражение для коэффициента Джоуля — Томсона , который связывает малые изменения температуры и давления в этом процессе. Приравнивание нулю дифференциала (сохраняющейся) энтальпии в переменных даёт[65][66] и
а выражение для дифференциала энтальпии в переменных даёт связь между изменениями давления и энтропии:
В процессе Джоуля — Томсона давление всегда убывает, следовательно, энтропия возрастает.
Полная энергия и полная энтальпия
Для движущихся тел помимо внутренней энергии, включающей кинетическую энергию теплового движения составляющих тело частиц (измеренную в системе координат, в которой тело как целое покоится), вводят также его полную энергию в системе координат, относительно которой тело движется со скоростью . Обычно полная энергия тела есть просто сумма его внутренней и кинетической энергий Более общий и строгий подход определяет не полную энергию, а её дифференциал[67]:
(Дифференциал полной энергии)
где — импульс тела и точка между векторами означает их скалярное произведение. В полную энтальпию также включается кинетическая энергия. Имеющие большое значение для физики сплошных сред удельная полная энергия и удельная полная энтальпия (обычно называемая просто «полная энтальпия» или, особенно в технических науках, «энтальпия торможения») даются формулами:
Обобщение дифференциала плотности энергии для полной энергии принимает вид[47]:
(Дифференциал плотности полной энергии)
Если скорость тела сравнима по величине со скоростью света , термодинамика строится с учётом специальной теории относительности)[67]. При этом используется инвариантная энтальпия , которая представляет собой полную энтальпию, определённую в движущейся вместе с телом системе отсчёта; все величины в этой системе отсчёта обозначаем нижним индексом «0».
Релятивистская полная энергия , включает энергию покоя всех частиц тела и учитывает релятивистскую зависимость их энергии от импульса , а именно: 1) энергия и импульс образуют 4-вектор, 2) величина является Лоренц-инвариантом и 3) величина являются скоростью частицы. В неподвижной системе отсчёта энтальпия и импульс движущегося тела[68][67]
образуют 4-вектор, а инвариантная энтальпии в движущейся с телом системы отсчёта даётся инвариантной функцией этого 4-вектора:
Именно полная энтальпия (а не энергия) релятивистского тела оказывается аналогом энергии релятивистской частицы. Давление лоренц-инвариантно, а преобразование объёма :
является следствием Лоренцева сокращения. Уравнение релятивистской термодинамики даётся выражением[68]:
Оно позволяет решить любой вопрос термодинамики движущихся систем, если известна функция [68]. В частности, из выражения для Дифференциала полной энергии можно получить выражение для малого количества теплоты[67]:
Энтальпия в гидродинамике
Энтальпия играет большую роль в гидродинамике, науке о движениях жидкостей и газов (в гидродинамике газы тоже называют жидкостями). Течения идеальной жидкости (то есть без вязкости и теплопроводности) описываются следующими уравнениями в частных производных[69]:
где — плотность; — скорость; — давление; — время; — векторный оператор частного дифференцирования по координатам ; точка между векторами в круглых скобках означает их скалярное произведение, а — ускорение силы тяжести, выраженное через гравитационный потенциал Уравнение для Дифференциала удельной энтальпии даёт: что позволяет выразить уравнение Эйлера через энтальпию:
(Уравнение Эйлера, выраженное через энтальпию)
Такое представление обладает значительными преимуществами, поскольку в силу «адабатичности» течения идеальной жидкости, задаваемого уравнением сохранения энтропии:
член в уравнении Эйлера, связанный с градиентом энтропии, во многих случаях не даёт вклада в рассчитываемые эффекты.
Выражение для дифференциала плотности полной энергии позволяет получить скорость изменения последней[47]:
Из приведённых здесь термодинамических соотношений для энтальпии следует простой вывод интеграла Бернулли и в наиболее общей его форме. Закон утверждает, что вдоль линии тока для стационарного течения идеальной жидкости[70] сохраняется следующая величина:
где — гравитационный потенциал (равный для однородной силы тяжести, — ускорение свободного падения, — вертикальная координата).
Вывод закона Бернулли из уравнения Эйлера и термодинамических соотношений
1. В уравнении Эйлера для стационарного () движения идеальной жидкости в поле силы тяжести[69] ускорение силы тяжести можно выразить через гравитационный потенциал (для однородного поля ).
2. Скалярное произведение этого уравнения на единичный вектор касательный к линии тока даёт:
так как произведение градиента на единичный вектор даёт производную по направлению
3. Выражение для Дифференциала удельной энтальпии даёт:
так что
В стационарном течении идеальной жидкости все частицы, движущиеся вдоль данной линии тока, имеют одинаковую энтропию[71] (), поэтому вдоль линии тока:
Литература
- Алабовский А. Н., Недужий И. А. Техническая термодинамика и теплопередача. — 3-е изд., пераб. и доп. — Киев: Выща школа, 1990. — 256 с. — ISBN 5-11-001997-5.
- Ансельм А. И. Основы статистической физики и термодинамики. — 2-е изд., стереотип. — СПб.: Лань, 2007. — 427 с. — (Учебники для вузов. Специальная литература). — ISBN 978-5-8114-0756-9.
- Артемов А. В. Физическая химия. — М.: Академия, 2013. — 288 с. — (Бакалавриат). — ISBN 978-5-7695-9550-9.
- Ахметов Б. В., Новиченко Ю. П., Чапурин В. И. Физическая и коллоидная химия. — Л.: Химия, 1986. — 320 с.
- Базаров И. П. Термодинамика. — 5-е изд. — СПб.—М.—Краснодар: Лань, 2010. — 384 с. — (Учебники для вузов. Специальная литература). — ISBN 978-5-8114-1003-3.
- Белов Г. В. Термодинамика. Часть 1. — 2-е изд., испр. и доп. — М.: Юрайт, 2017. — 265 с. — (Бакалавр. Академический курс). — ISBN 978-5-534-02731-0.
- Белов Г. В. Термодинамика. Часть 2. — М.: Юрайт, 2016. — 249 с. — (Бакалавриат). — ISBN 978-5-9916-7252-8.
- Беляев Н. М. Термодинамика. — Киев: Вища школа, 1987. — 344 с.
- Болгарский А. В., Мухачев Г. А., Щукин В. К. Термодинамика и теплопередача. — 2-е изд., перераб. и доп. — М.: Высшая школа, 1975. — 496 с.
- Борщевский А. Я. Физическая химия. Том 1 online. Общая и химическая термодинамика. — М.: Инфра-М, 2017. — 868 с. — (Высшее образование: Бакалавриат). — ISBN 978-5-16-104227-4.
- Буданов В. В., Максимов А. И. Химическая термодинамика / Под ред. О. И. Койфмана. — 3-е изд., стер. — СПб.: Лань, 2017. — 320 с. — (Учебники для вузов. Специальная литература). — ISBN 978-5-8114-2271-5.
- Вишневецкий С. Л. Бернулли уравнение // Физическая энциклопедия. — Большая Российская энциклопедия, 1988. — Т. 5: Стробоскопические приборы — Яркость. — С. 187.
- Воронин Г. Ф. Основы термодинамики. — М.: Изд-во Моск. ун-та, 1987. — 192 с.
- Гамбург Ю. Д. Химическая термодинамика. — М.: Лаборатория знаний, 2016. — 237 с. — (Учебник для высшей школы). — ISBN 978-5-906828-74-3.
- Герасимов Я. И., Древинг В. П., Еремин Е. Н. и др. Курс физической химии / Под общ. ред. Я. И. Герасимова. — 2-е изд., испр. — М.: Химия, 1970. — Т. 1. — 592 с.
- Гиббс Дж. В. Термодинамические работы / Пер. с англ. под ред. проф. В. К. Семенченко. — М. — Л.: Гостехиздат, 1950. — 492 с. — (Классики естествознания).
- Гиббс Дж. В. Термодинамика. Статистическая механика / Отв. ред. Д. Н. Зубарев. — М.: Наука, 1982. — 584 с. — (Классики науки).
- Горшков В. И., Кузнецов И. А. Основы физической химии. — 3-е изд. — М.: Бином. Лаборатория знаний, 2009. — 408 с. — ISBN 978-5-94774-375-3.
- Еремин В. В., Каргов С. И., Успенская И. А. и др. Основы физической химии. Теория и задачи. — М.: Экзамен, 2005. — 481 с. — (Классический университетский учебник). — ISBN 5-472-00834-4.
- Зарубин Д. П. Физическая химия. — М.: Инфра-М, 2017. — 474 с.
- Зубарев, Д. Н. Потенциал термодинамический // Физическая энциклопедия / Гл. ред. А. М. Прохоров. — М.: Большая российская энциклопедия, 1994. — Т. 4: Пойнтинга-Робертсона эффект — Стримеры. — С. 89—91. — 704 с. — ISBN 5-85270-087-8.
- Зубарев, Д. Н. Работа в термодинамике // Физическая энциклопедия / Гл. ред. А. М. Прохоров. — М.: Большая российская энциклопедия, 1994. — Т. 4: Пойнтинга-Робертсона эффект — Стримеры. — С. 193. — 704 с. — ISBN 5-85270-087-8.
- Зубарев, Д. Н. Релятивистская термодинамика // Физическая энциклопедия / Гл. ред. А. М. Прохоров. — М.: Большая российская энциклопедия, 1994. — Т. 4: Пойнтинга-Робертсона эффект — Стримеры. — С. 333—334. — 704 с. — ISBN 5-85270-087-8.
- Зубарев Д. Н. Термодинамика // Физическая энциклопедия / Ред.А. М. Прохоров. — М.: Большая Советская Энциклопедия, 1992. — Т. 5. — С. 83—87.
- Зубарев Д. Н. Энтальпия // Физическая энциклопедия / Ред. А. М. Прохоров. — М.: Большая Советская Энциклопедия, 1992. — Т. 5. — С. 616.
- Ипполитов Е. Г., Артемов А. В., Батраков В.В. Физическая химия / Под ред. Е. Г. Ипполитова. — М.: Академия, 2005. — 448 с. — (Высшее профессиональное образование). — ISBN 978-5-7695-1456-6.
- Каллен Г., Горвиц Дж. Релятивистская термодинамика // Успехи Физических Наук : журнал. — 1972. — Т. 107, вып. 7. — С. 489—502. — doi:10.3367/UFNr.0107.197207g.0489.
- Колесников И. М., Винокуров В. А. Термодинамика физико-химических процессов. — 2-е, перераб. и доп. — М.: Нефть и газ, 2005. — 480 с. — ISBN 5-7246-0351-9.
- Кубо Р. Термодинамика. — М.: Мир, 1970. — 304 с.
- Ландау Л. Д., Лифшиц Е. М. Гидродинамика. — Издание 6-е, исправленное. — М.: Физматлит, 2015. — 728 с. — («Теоретическая физика», том VI). — ISBN 978-5-9221-1625-1.
- Ландау Л. Д., Лифшиц Е. М. Статистическая физика. Часть 1. — Издание 5-е. — М.: Физматлит, 2002. — 616 с. — («Теоретическая физика», том V). — ISBN 5-9221-0054-8.
- Мечковский Л. А., Блохин А. В. Химическая термодинамика. В двух частях. Часть 1. Феноменологическая термодинамика. Основные понятия, фазовые равновесия. — Минск: Издательство БГУ, 2012. — 141 с. — ISBN 978-985-518-635-0.
- Мюнстер А. Химическая термодинамика / Пер. с нем. под. ред. чл.-корр. АН СССР Я. И. Герасимова. — 2-е изд., стереотип. — М.: УРСС, 2002. — 296 с. — ISBN 5-354-00217-6.
- Новиков И. И. Термодинамика. — 2-е изд., испр. — СПб.: Лань, 2009. — 592 с. — (Учебники для вузов. Специальная литература). — ISBN 978-5-8114-0987-7.
- Поль Р. В. Механика, акустика и учение о теплоте. — Рипол Классик, 2013. — 490 с. — ISBN 5458431251, 9785458431255.
- Пригожин И., Дефэй Р. Химическая термодинамика / Пер. с англ. под ред. В. А. Михайлова. — 2-е изд.. — М.: Бином. Лаборатория знаний, 2009. — 533 с. — (Классика и современность. Естествознание). — ISBN 978-5-9963-0201-7.
- Савельев И. В. Курс общей физики. — М.: КноРус, 2012. — Т. 1. Механика. Молекулярная физика и термодинамика. — 528 с. — ISBN 9785406025888.
- Свиридов В. В., Свиридов А. В. Физическая химия. — СПб.: Лань, 2016. — 597 с. — ISBN 978-5-8114-2262-3.
- Седов Л. И. Механика сплошной среды. — М.: Наука, 1970. — Т. 2. — 568 с.
- Сивухин Д. В. Общий курс физики. — Издание 5-е, исправленное. — М.: Физматлит, 2005. — Т. II. Термодинамика и молекулярная физика. — 544 с. — ISBN 5-9221-0601-5.
- Степановских Е. И., Брусницына Л. А., Маскаева Л. Н. Химическая термодинамика в вопросах и ответах. — Екатеринбург: Уральский издательско-полиграфический центр, 2014. — 221 с. — [[Служебная:Источники книг/978-5-4430-0061-9|ISBN 978-5-4430-0061-9]].
- Сычёв В. В. Сложные термодинамические системы. — 5-е изд., перераб. и доп. — М.: Издательский дом МЭИ, 2009. — 296 с. — ISBN 978-5-383-00418-0.
- Термодинамика. Основные понятия. Терминология. Буквенные обозначения величин / Отв. ред. И. И. Новиков. — АН СССР. Комитет научно-технической терминологии. Сборник определений. Вып. 103. — М.: Наука, 1984. — 40 с.
- Хаазе Р. Термодинамика необратимых процессов / Пер. с нем. под ред. А. В. Лыкова. — М.: Мир, 1967. — 544 с.
- Хачкурузов Г. А. Основы общей и химической термодинамики. — М.: Высшая школа, 1979. — 268 с.
- Dalton J. P. Researches on the Joule-Kelvin effect, especially at low temperatures. I. Calculations for hydrogen // KNAW Proceedings. — 1909. — Т. 11. — С. 863—873.
- Howard Irmgard K. H Is for Enthalpy, Thanks to Heike Kamerlingh Onnes and Alfred W. Porter (англ.) // Journal of Chemical Education : журнал. — 2002. — Vol. 79, iss. 6. — P. 697—698. — ISSN 0021-9584. — doi:10.1021/ed079p697.
- Van Ness Hendrick C. H Is for Enthalpy (англ.) // Journal of Chemical Education : журнал. — 2003. — Vol. 80, iss. 5. — P. 486. — ISSN 0021-9584. — doi:10.1021/ed080p486.1.
- Part 1 : Engines — Fundamentals // Encyclopedia of Automitive Engineering / Editors-in-Chief : David Crolla, David E. Foster, Toshio Kobayashi, Nicolas Vaughan. — John Wiley & Sons, 2015. — Т. 1. — 607 с. — ISBN 978-0-470-97402-5.


































































































![{\displaystyle \quad \mathrm {d} H=C_{P}\mathrm {d} T+\left[V-T\left({\frac {\partial V}{\partial T}}\right)_{P}\right]\mathrm {d} P.}](https://ru.ruwiki.ru/api/rest_v1/media/math/render/svg/db8b72626dbc316bfcff5dcbb2aae49c93912304)



















![{\displaystyle C_{P}\mathrm {d} T+\left[V-T\left({\frac {\partial V}{\partial T}}\right)_{P}\right]\mathrm {d} P=0}](https://ru.ruwiki.ru/api/rest_v1/media/math/render/svg/10e30be2110fa951c716fb887b72bb50a0fe82b4)























































