HIF1A
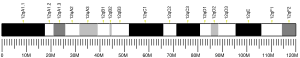
HIF1A, также HIF-1α (сокр. от англ. Hypoxia-inducible factor 1-alpha) — фактор, индуцируемый гипоксией 1-альфа, белок, является субъединицей гетеродимерного фактора транскрипции, фактора, индуцируемого гипоксией 1 (HIF-1), который кодируется одноимённым геном HIF1A, локализованный на длинном плече (q-плече) 14-ой хромосомы[5][6].
Белок относится к семейству bHLH, содержащий домен PAS, и считается основным регулятором транскрипции клеточного и развивающего ответа на гипоксию[7][8].
Нарушение регуляции и сверхэкспрессия HIF-1α либо гипоксия или генетические изменения были в значительной степени вовлечены в этиологии рака, а также с рядом других патофизиологий, особенно в областях васкуляризации и ангиогенеза, энергетического обмена, выживаемости клеток и инвазии опухолей[9][10].
Структура
HIF1 представляет собой гетеродимерную bHLH-структуру[11], состоящую из двух субъединиц — HIF-1α или α-субъединицы и ядерного транслокатора AH-рецептора (ARNT), β-субъединицы. HIF-1α содержит базовую область спираль-петля-спираль (helix-loop-helix) рядом с C-концом, за которой следуют два разных домена PAS (PER-ARNT-SIM) и PAC (PAS-ассоциированный с C-концом домен)[7][12]. Полипептид HIF-1α также содержит мотив сигнала ядерной локализации (NTL), два трансактивирующих домена CTAD и NTAD и промежуточный ингибирующий домен (ID), который может подавлять транскрипционные активности CTAD и NTAD[13]. В общей сложности имеется три изоформы HIF1A, образованные путём альтернативного сплайсинга, однако изоформа 1 была выбрана в качестве канонической структуры и является наиболее широко изученной изоформой в структуре и по выполняемым функциям[14][15].
Гены и экспрессия
Ген HIF1A человека кодирует альфа-субъединицу, транскрипционный фактор HIF-1A, фактора, индуцируемого гипоксией (HIF1)[16]. Уровень экспрессии HIF-1A зависит от его активизации GC-промоторной области[17]. В нормоксических условиях (при нормальной концентрации кислорода) в большинстве клеток ген HIF1A конститутивно экспрессируется на низких уровнях, однако при гипоксии транскрипция HIF1A часто значительно повышается[17][18][19][20][21][22]. Как правило, кислород-независимый путь регулирует экспрессию белка, а зависящий от кислорода путь регулирует деградацию[23]. При независимом от гипоксии способе экспрессия HIF1A может регулироваться через чувствительным к окислительно-восстановительным реакциям механизмом[24].
Выполняемые функции
Фактор транскрипции HIF-1 играет важную роль в клеточном ответе на системные уровни кислорода у млекопитающих[25][26]. Активность HIF1A регулируется множеством посттрансляционных модификаций: гидроксилирование, ацетилирование и фосфорилирование[27]. HIF-1, как известно, индуцирует транскрипцию более 60 генов, включая VEGF и эритропоэтин, участвующих в биологических процессах, таких как ангиогенез и эритропоэз, которые способствуют продвижению и увеличению доставки кислорода в гипоксические области[10][28][29]. HIF-1 также индуцирует транскрипцию генов, участвующих в пролиферации и выживаемости клеток, а также в метаболизме глюкозы и железа[29]. В соответствии с его динамической биологической ролью HIF-1 реагирует на системные уровни кислорода, подвергаясь конформационным изменениям, и связывается с HRE-промоторными регионами генов, чувствительных к гипоксии, для последующей индукции транскрипции[30][31][32][33][34]. Стабильность HIF-1α, субклеточная локализация, а также активность транскрипции особенно зависят от уровня кислорода. Альфа-субъединица образует гетеродимер с бета-субъединицей. При нормоксических условиях VHL-опосредованный путь убиквитин-протеазы быстро разрушает молекулы HIF-1α; однако при гипоксии предотвращается деградация белка HIF-1α и происходит накопление HIF-1A, чтобы связываться с HIF-1β для осуществления транскрипционных ролей генов-мишеней[35][36]. Ферменты пролилгидроксилаза (PHD) и HIF-пролилгидроксилаза (HPH) участвуют в специфической посттрансляционной модификации остатков пролина HIF-1A (P402 и P564 в домене ODD), позволяющую связывать VHL с HIF-1α[34]. Ферментативная активность кислородного датчика диоксигеназы PHD зависит от уровня кислорода, так как он требует кислорода в качестве одного из основных субстратов для переноса на остаток пролина HIF-1α[31][37]. Затем гидроксилированный остаток пролина HIF-1α распознаётся и погружается в гидрофобное ядро онкосупрессорного белка von Hippel—Lindau (VHL), который сам является частью фермента убиквитинлигазы[38][39]. Гидроксилирование остатка пролина HIF-1α также регулирует его способность связываться с коактиваторами при гипоксии[40][41]. Функция гена HIF1A может быть эффективно исследована нокдауном siRNA, основанной на независимой проверке[42].
Участие в регенерации
В нормальных условиях после травмы происходит деградация HIF-1α пролилгидроксилазами (PHD). В июне 2015 года учёные обнаружили, что продолжение регуляции HIF-1α через ингибиторы PHD восстанавливает потерянные или повреждённые ткани у млекопитающих, которые имеют ответ на восстановление; и продолжающаяся понижающая регуляция HIF-1α приводит к заживлению с помощью рубцевого ответа у млекопитающих с предыдущим восстановительным ответом на потерю ткани. Акт регулирования HIF-1α может либо отключить, либо включить ключевые процессы регенерации млекопитающих[43][44].
Регуляция
Содержание HIF-1α (и его последующая активность) регулируется транскрипционно с помощью NF-κB-зависимого способа[45]. Кроме того, скоординированная активность пролилгидроксилаз (PHD) поддерживает соответствующий баланс белка HIF-1A в посттрансляционной фазе[46].
Факторы, увеличивающие концентрацию HIF-1A[47]:
- Модуляторы деградации:
- Кислородно-зависимые
- EPP UCP (деградирует pHVL)
- VDU2 (де-убивиктиназы HIF-1A)
- SUMOляция (через RSUME)
- ДеSUMOляция(через SENP1)
- Кислородно-независимые:
- Кальцинеурин A (Ca2+-зависимый, через RACK1)
- Кислородно-зависимые
- Модуляторы транскрипции:
Факторы уменьшающие концентрацию HIF-1A[47]:
Участие в канцерогенезе
HIF-1 сверхэкспрессируется при многих злокачественных новообразованиях человека[48][49]. Сверхэкспрессия HIF-1 в значительной степени связана с продвижением роста опухоли и метастазов, посредством участии в инициировании ангиогенеза и регулировании клеточного метаболизма для преодоления гипоксии[50]. Гипоксия способствует апоптозу как в нормальных, так и в опухолевых клетках[51]. Однако гипоксические условия в микроокружении опухоли особенно, наряду с накоплением генетических изменений (мутаций), часто способствуют избыточной экспрессии HIF-1[10].
Значительная экспрессия HIF-1 отмечена в большинстве исследованных солидных опухолей, которые включают рак толстой кишки, карцинома молочной железы, поджелудочной железы, почек, аденокарцинома предстательной железы, карцинома яичника, рак головного мозга и мочевого пузыря[49][52]. Клинически повышенные уровни HIF-1 в ряде видов рака, включая рак шейки матки, немелкоклеточный рак лёгкого, рак молочной железы (LV-положительный и отрицательный), олигодендроглиома, рак орофарингии, рак яичников, рак эндометрия, рак пищевода, опухоли головы и шеи, и рак желудка, были связаны с агрессивной прогрессией опухоли и, таким образом, были замечены как прегностический и прогностический маркер устойчивости к лучевой терапии, химиотерапии и повышенной смертности[23][50][53][53][54][55][56].
Экспрессия HIF-1A также может регулировать прогрессирование опухоли молочной железы. Повышенные уровни HIF-1A могут быть обнаружены при раннем развитии рака и были обнаружены при ранней карциноме in situ протоков, доинвазивной стадии развития рака молочной железы, а также связаны с повышенной плотностью микроциркуляторности при опухолевых поражениях[57]. Более того, несмотря на гистологически определённую низкосортную, отрицательную опухоль молочной железы лимфатических узлов в подгруппе исследованных пациентов, обнаружение значительной экспрессии HIF-1A способно самостоятельно предсказать плохой ответ на терапию[50]. Аналогичные результаты были опубликованы в исследованиях рака мозга и рака яичников, а также указывают на регуляторную роль HIF-1A в инициировании ангиогенеза посредством взаимодействия с проангиогенными факторами, такими как VEGF[56][58]. Исследования мультиформной глиобластомы показывают поразительное сходство между моделью экспрессии HIF-1A и уровнем транскрипции гена VEGF[59][60]. Кроме того, высокосортные глиобластома-мультиформные опухоли с высокой экспрессией VEGF, похожие на рак молочной железы с имеющейся гиперэкспрессией HIF-1A, демонстрируют значительные признаки процесса неоваскуляризации (новая васкуляризация) опухоли[61]. Это дополнительно указывает на регуляторную роль HIF-1A в продвижении прогрессирования опухоли, вероятно, посредством индуцированных гипоксией путей экспрессии VEGF[60].
Сверхэкспрессия HIF-1A в опухолях может также возникать в гипоксически-независимом пути. В гемагиобластоме экспрессия HIF-1A встречается в большинстве клеток, отобранных из хорошо васкуляризированной опухоли[62]. Хотя при карциноме почки и гемагиобластоме ген von Hippel-Lindau инактивирован, HIF-1A всё ещё экспрессируется на достаточно высоких уровнях[52][58][62]. В дополнение к сверхэкспрессии VEGF в ответных повышенных уровнях HIF-1A путь PI3K/AKT также участвует в росте опухоли. При раке предстательной железы часто встречающаяся мутация PTEN, связана с прогрессированием опухоли в сторону маглинизационной стадии, повышенной сосудистой плотностью и ангиогенезом[63].
Во время гипоксии, избыточная экспрессия опухолевого супрессора р53 может быть связана с HIF-1A-зависимым путём для инициирования апоптоза[51]. Более того, p53-независимый путь может также индуцировать апоптоз через путь Bcl-2. Однако чрезмерная экспрессия HIF-1A является туморогенной и индивидуально-специфической и зависит от сопровождающих генетических изменений и уровней присутствующих про-и антиапоптотических факторов. Одно исследование, связанное с карциномой эпителия яичников показало, что HIF-1A и нефункциональный супрессор опухолей р53 имеет корреляцию с низкими уровнями апоптоза опухолевых клеток и плохим прогнозом[64]. Кроме того, ранние стадии рака пищевода с показанной сверхэкспрессией HIF-1 и отсутствием экспрессии BCL2 также не привели к фотодинамической терапии[65]. Исследования мультиформной глиобластомы показывают поразительное сходство между моделью экспрессии белка HIF-1A и уровнем транскрипции гена VEGF.
Хотя исследовательские усилия по разработке терапевтических препаратов для лечения связанных с гипоксией опухолевых клеток продолжаются в течение многих лет, до сих пор нет никакого прорыва, который показал селективность и эффективность при нацеливании на HIF-1A-путь для уменьшения прогрессирования опухоли и ангиогенеза[66]. Успешные терапевтические подходы в будущем также могут быть особенно специфичными для конкретных видов рака у людей и, по-видимому, вряд ли будут широко применяться из-за генетически гетерогенного характера многих типов и подтипов рака.
Взаимодействия с белками
HIF-1A взаимодействует со следующими белками:
См. также
Примечания
- ↑ 1 2 3 GRCh38: Ensembl release 89: ENSG00000100644 - Ensembl, May 2017
- ↑ 1 2 3 GRCm38: Ensembl release 89: ENSMUSG00000021109 - Ensembl, May 2017
- ↑ Ссылка на публикацию человека на PubMed: Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ↑ Ссылка на публикацию мыши на PubMed: Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ↑ Semenza G.L., Rue E.A., Iyer N.V., Pang M.G., Kearns W.G. Assignment of the hypoxia-inducible factor 1alpha gene to a region of conserved synteny on mouse chromosome 12 and human chromosome 14q (англ.) // Genomics : journal. — Academic Press, 1996. — June (vol. 34, no. 3). — P. 437—439. — doi:10.1006/geno.1996.0311. — PMID 8786149.
- ↑ 1 2 Hogenesch J.B., Chan W.K., Jackiw V.H., Brown R.C., Gu Y.Z., Pray-Grant M., Perdew G.H., Bradfield C.A. Characterization of a subset of the basic-helix-loop-helix-PAS superfamily that interacts with components of the dioxin signaling pathway (англ.) // Journal of Biological Chemistry : journal. — 1997. — March (vol. 272, no. 13). — P. 8581—8593. — doi:10.1074/jbc.272.13.8581. — PMID 9079689.
- ↑ 1 2 Wang G.L., Jiang B.H., Rue E.A., Semenza G.L. Hypoxia-inducible factor 1 is a basic-helix-loop-helix-PAS heterodimer regulated by cellular O2 tension (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1995. — June (vol. 92, no. 12). — P. 5510—5514. — doi:10.1073/pnas.92.12.5510. — PMID 7539918. — PMC 41725.
- ↑ Iyer N.V., Kotch L.E., Agani F., Leung S.W., Laughner E., Wenger R.H., Gassmann M., Gearhart J.D., Lawler A.M., Yu A.Y., Semenza G.L. Cellular and developmental control of O2 homeostasis by hypoxia-inducible factor 1 alpha (англ.) // Genes & Development : journal. — 1998. — January (vol. 12, no. 2). — P. 149—162. — doi:10.1101/gad.12.2.149. — PMID 9436976. — PMC 316445.
- ↑ Entrez Gene: HIF1A hypoxia-inducible factor 1, alpha subunit (basic helix-loop-helix transcription factor).
- ↑ 1 2 3 Semenza G.L. Targeting HIF-1 for cancer therapy (англ.) // Nature Reviews Cancer : journal. — 2003. — October (vol. 3, no. 10). — P. 721—732. — doi:10.1038/nrc1187. — PMID 13130303.
- ↑ Wang F.S., Wang C.J., Chen Y.J., Chang P.R., Huang Y.T., Sun Y.C., Huang H.C., Yang Y.J., Yang K.D. Ras induction of superoxide activates ERK-dependent angiogenic transcription factor HIF-1alpha and VEGF-A expression in shock wave-stimulated osteoblasts (англ.) // Journal of Biological Chemistry : journal. — 2004. — March (vol. 279, no. 11). — P. 10331—10337. — doi:10.1074/jbc.M308013200. — PMID 14681237.
- ↑ Hogenesch J.B., Chan W.K., Jackiw V.H., Brown R.C., Gu Y.Z., Pray-Grant M., Perdew G.H., Bradfield C.A. Characterization of a subset of the basic-helix-loop-helix-PAS superfamily that interacts with components of the dioxin signaling pathway (англ.) // Journal of Biological Chemistry : journal. — 1997. — March (vol. 272, no. 13). — P. 8581—8593. — doi:10.1074/jbc.272.13.8581. — PMID 9079689.
- ↑ Jiang B.H., Zheng J.Z., Leung S.W., Roe R., Semenza G.L. Transactivation and inhibitory domains of hypoxia-inducible factor 1alpha. Modulation of transcriptional activity by oxygen tension (англ.) // Journal of Biological Chemistry : journal. — 1997. — August (vol. 272, no. 31). — P. 19253—19260. — doi:10.1074/jbc.272.31.19253. — PMID 9235919.
- ↑ Iyer N.V., Leung S.W., Semenza G.L. The human hypoxia-inducible factor 1alpha gene: HIF1A structure and evolutionary conservation (англ.) // Genomics : journal. — Academic Press, 1998. — September (vol. 52, no. 2). — P. 159—165. — doi:10.1006/geno.1998.5416. — PMID 9782081.
- ↑ Hypoxia-inducible factor 1-alpha (2014). Дата обращения: 13 сентября 2017. Архивировано 13 сентября 2017 года.
- ↑ HIF1A. National Center for Biotechnology Information. Дата обращения: 14 сентября 2017. Архивировано 2 октября 2016 года.
- ↑ 1 2 Minet E., Ernest I., Michel G., Roland I., Remacle J., Raes M., Michiels C. HIF1A gene transcription is dependent on a core promoter sequence encompassing activating and inhibiting sequences located upstream from the transcription initiation site and cis elements located within the 5'UTR (англ.) // Biochemical and Biophysical Research Communications : journal. — 1999. — August (vol. 261, no. 2). — P. 534—540. — doi:10.1006/bbrc.1999.0995. — PMID 10425220.
- ↑ Danon A., Assouline G. Antiulcer activity of hypertonic solutions in the rat: possible role of prostaglandins (англ.) // European Journal of Pharmacology : journal. — Vol. 58, no. 4. — P. 425—431. — doi:10.1016/0014-2999(79)90313-3.
- ↑ Ladoux A., Frelin C. Cardiac expressions of HIF-1 alpha and HLF/EPAS, two basic loop helix/PAS domain transcription factors involved in adaptative responses to hypoxic stresses (англ.) // Biochemical and Biophysical Research Communications : journal. — 1997. — November (vol. 240, no. 3). — P. 552—556. — doi:10.1006/bbrc.1997.7708. — PMID 9398602.
- ↑ Wiener C.M., Booth G., Semenza G.L. In vivo expression of mRNAs encoding hypoxia-inducible factor 1 (англ.) // Biochemical and Biophysical Research Communications : journal. — 1996. — August (vol. 225, no. 2). — P. 485—488. — doi:10.1006/bbrc.1996.1199. — PMID 8753788.
- ↑ Palmer L.A., Semenza G.L., Stoler M.H., Johns R.A. Hypoxia induces type II NOS gene expression in pulmonary artery endothelial cells via HIF-1 (англ.) // American Physiological Society : journal. — 1998. — February (vol. 274, no. 2 Pt 1). — P. L212—9. — PMID 9486205.
- ↑ Wenger R.H., Kvietikova I., Rolfs A., Gassmann M., Marti H.H. Hypoxia-inducible factor-1 alpha is regulated at the post-mRNA level (англ.) // Kidney International : journal. — 1997. — February (vol. 51, no. 2). — P. 560—563. — doi:10.1038/ki.1997.79. — PMID 9027739.
- ↑ 1 2 Semenza G.L. Targeting HIF-1 for cancer therapy (англ.) // Nature Reviews Cancer : journal. — 2003. — October (vol. 3, no. 10). — P. 721—732. — doi:10.1038/nrc1187. — PMID 13130303.
- ↑ Bonello S., Zähringer C., BelAiba R.S., Djordjevic T., Hess J., Michiels C., Kietzmann T., Görlach A. Reactive oxygen species activate the HIF-1alpha promoter via a functional NFkappaB site (англ.) // Arteriosclerosis, Thrombosis, and Vascular Biology : journal. — 2007. — April (vol. 27, no. 4). — P. 755—761. — doi:10.1161/01.ATV.0000258979.92828.bc. — PMID 17272744.
- ↑ Semenza G.L. Regulation of mammalian O2 homeostasis by hypoxia-inducible factor 1 (англ.) // Annual Review of Cell and Developmental Biology : journal. — 1999. — Vol. 15. — P. 551—578. — doi:10.1146/annurev.cellbio.15.1.551. — PMID 10611972.
- ↑ Semenza G.L. HIF-1: mediator of physiological and pathophysiological responses to hypoxia (англ.) // Journal of Applied Physiology : journal. — 2000. — April (vol. 88, no. 4). — P. 1474—1480. — PMID 10749844.
- ↑ Lee J.W., Bae S.H., Jeong J.W., Kim S.H., Kim K.W. Hypoxia-inducible factor (HIF-1)alpha: its protein stability and biological functions (англ.) // Experimental and Molecular Medicine : journal. — 2004. — February (vol. 36, no. 1). — P. 1—12. — doi:10.1038/emm.2004.1. — PMID 15031665.
- ↑ Semenza G.L. HIF-1 and tumor progression: Pathophysiology and therapeutics (англ.) // Trends (journals) : journal. — 2002. — Vol. 8, no. 4 Suppl. — P. S62—7. — doi:10.1016/s1471-4914(02)02317-1. — PMID 11927290.
- ↑ 1 2 Lee J.W., Bae S.H., Jeong J.W., Kim S.H., Kim K.W. Hypoxia-inducible factor (HIF-1)alpha: its protein stability and biological functions (англ.) // Experimental and Molecular Medicine : journal. — 2004. — February (vol. 36, no. 1). — P. 1—12. — doi:10.1038/emm.2004.1. — PMID 15031665.
- ↑ Bruick R.K., McKnight S.L. A conserved family of prolyl-4-hydroxylases that modify HIF (англ.) // Science : journal. — 2001. — November (vol. 294, no. 5545). — P. 1337—1340. — doi:10.1126/science.1066373. — PMID 11598268.
- ↑ 1 2 Epstein A.C., Gleadle J.M., McNeill L.A., Hewitson K.S., O'Rourke J., Mole D.R., Mukherji M., Metzen E., Wilson M.I., Dhanda A., Tian Y.M., Masson N., Hamilton D.L., Jaakkola P., Barstead R., Hodgkin J., Maxwell P.H., Pugh C.W., Schofield C.J., Ratcliffe P.J. C. elegans EGL-9 and mammalian homologs define a family of dioxygenases that regulate HIF by prolyl hydroxylation (англ.) // Cell : journal. — Cell Press, 2001. — October (vol. 107, no. 1). — P. 43—54. — doi:10.1016/s0092-8674(01)00507-4. — PMID 11595184.
- ↑ Ivan M., Kondo K., Yang H., Kim W., Valiando J., Ohh M., Salic A., Asara J.M., Lane W.S., Kaelin W.G. HIFalpha targeted for VHL-mediated destruction by proline hydroxylation: implications for O2 sensing (англ.) // Science : journal. — 2001. — April (vol. 292, no. 5516). — P. 464—468. — doi:10.1126/science.1059817. — PMID 11292862.
- ↑ Jaakkola P., Mole D.R., Tian Y.M., Wilson M.I., Gielbert J., Gaskell S.J., von Kriegsheim A., Hebestreit H.F., Mukherji M., Schofield C.J., Maxwell P.H., Pugh C.W., Ratcliffe P.J. Targeting of HIF-alpha to the von Hippel-Lindau ubiquitylation complex by O2-regulated prolyl hydroxylation (англ.) // Science : journal. — 2001. — April (vol. 292, no. 5516). — P. 468—472. — doi:10.1126/science.1059796. — PMID 11292861.
- ↑ 1 2 Masson N., Willam C., Maxwell P.H., Pugh C.W., Ratcliffe P.J. Independent function of two destruction domains in hypoxia-inducible factor-alpha chains activated by prolyl hydroxylation (англ.) // The EMBO Journal : journal. — 2001. — September (vol. 20, no. 18). — P. 5197—5206. — doi:10.1093/emboj/20.18.5197. — PMID 11566883. — PMC 125617.
- ↑ Huang L.E., Arany Z., Livingston D.M., Bunn H.F. Activation of hypoxia-inducible transcription factor depends primarily upon redox-sensitive stabilization of its alpha subunit (англ.) // Journal of Biological Chemistry : journal. — 1996. — December (vol. 271, no. 50). — P. 32253—32259. — doi:10.1074/jbc.271.50.32253. — PMID 8943284.
- ↑ Kallio P.J., Pongratz I., Gradin K., McGuire J., Poellinger L. Activation of hypoxia-inducible factor 1alpha: posttranscriptional regulation and conformational change by recruitment of the Arnt transcription factor (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1997. — May (vol. 94, no. 11). — P. 5667—5672. — doi:10.1073/pnas.94.11.5667. — PMID 9159130. — PMC 20836.
- ↑ Jewell U.R., Kvietikova I., Scheid A., Bauer C., Wenger R.H., Gassmann M. Induction of HIF-1alpha in response to hypoxia is instantaneous (англ.) // The FASEB Journal : journal. — Federation of American Societies for Experimental Biology, 2001. — May (vol. 15, no. 7). — P. 1312—1314. — doi:10.1096/fj.00-0732fje. — PMID 11344124.
- ↑ Hon W.C., Wilson M.I., Harlos K., Claridge T.D., Schofield C.J., Pugh C.W., Maxwell P.H., Ratcliffe P.J., Stuart D.I., Jones E.Y. Structural basis for the recognition of hydroxyproline in HIF-1 alpha by VHL (англ.) // Nature : journal. — 2002. — June (vol. 417, no. 6892). — P. 975—978. — doi:10.1038/nature00767. — PMID 12050673.
- ↑ Min J.H., Yang H., Ivan M., Gertler F., Kaelin W.G., Pavletich N.P. Structure of an HIF-1alpha -VHL complex: hydroxyproline recognition in signaling (англ.) // Science : journal. — 2002. — June (vol. 296, no. 5574). — P. 1886—1889. — doi:10.1126/science.1073440. — PMID 12004076.
- ↑ 1 2 Lando D., Peet D.J., Whelan D.A., Gorman J.J., Whitelaw M.L. Asparagine hydroxylation of the HIF transactivation domain a hypoxic switch (англ.) // Science : journal. — 2002. — February (vol. 295, no. 5556). — P. 858—861. — doi:10.1126/science.1068592. — PMID 11823643.
- ↑ Sang N., Fang J., Srinivas V., Leshchinsky I., Caro J. Carboxyl-terminal transactivation activity of hypoxia-inducible factor 1 alpha is governed by a von Hippel-Lindau protein-independent, hydroxylation-regulated association with p300/CBP (англ.) // Molecular and Cellular Biology : journal. — 2002. — May (vol. 22, no. 9). — P. 2984—2992. — doi:10.1128/mcb.22.9.2984-2992.2002. — PMID 11940656. — PMC 133771.
- ↑ Munkácsy, Gyöngyi; Sztupinszki, Zsófia; Herman, Péter; Bán, Bence; Pénzváltó, Zsófia; Szarvas, Nóra; Győrffy, Balázs. Validation of RNAi Silencing Efficiency Using Gene Array Data shows 18.5% Failure Rate across 429 Independent Experiments (англ.) // Molecular Therapy - Nucleic Acids. — 2016. — Т. 5. — ISSN 2162-2531. — doi:10.1038/mtna.2016.66. — PMID 28131298. — PMC 5056990.
- ↑ eurekalert.org staff Scientist at LIMR leads study demonstrating drug-induced tissue regeneration. eurekalert.org. Lankenau Institute for Medical Research (LIMR), (3 июня 2015). Дата обращения: 3 июля 2015. Архивировано 11 июля 2018 года.
- ↑ Zhang Y., Strehin I., Bedelbaeva K., Gourevitch D., Clark L., Leferovich J., Messersmith P.B., Heber-Katz E. Drug-induced regeneration in adult mice (англ.) // Science Translational Medicine : journal. — 2015. — Vol. 290.
- ↑ van Uden P., Kenneth N.S., Rocha S. Regulation of hypoxia-inducible factor-1alpha by NF-kappaB (англ.) // Biochemical Journal : journal. — 2008. — Vol. 412, no. 3. — P. 477—484. — doi:10.1042/BJ20080476. — PMID 18393939. — PMC 2474706. Архивировано 2 сентября 2019 года.
- ↑ Semenza G.L. Hydroxylation of HIF-1: oxygen sensing at the molecular level (англ.) // Physiology (journal) : journal. — 2004. — August (vol. 19, no. 4). — P. 176—182. — doi:10.1152/physiol.00001.2004. — PMID 15304631.
- ↑ 1 2 Yee Koh M., Spivak-Kroizman T.R., Powis G. HIF-1 regulation: not so easy come, easy go (англ.) // Trends (journals) : journal. — 2008. — November (vol. 33, no. 11). — P. 526—534. — doi:10.1016/j.tibs.2008.08.002. — PMID 18809331.
- ↑ Zhong H., De Marzo A.M., Laughner E., Lim M., Hilton D.A., Zagzag D., Buechler P., Isaacs W.B., Semenza G.L., Simons J.W. Overexpression of hypoxia-inducible factor 1alpha in common human cancers and their Metastasis (англ.) // Cancer Research (журнал) : journal. — American Association for Cancer Research, 1999. — November (vol. 59, no. 22). — P. 5830—5835. — PMID 10582706.
- ↑ 1 2 Talks K.L., Turley H., Gatter K.C., Maxwell P.H., Pugh C.W., Ratcliffe P.J., Harris A.L. The expression and distribution of the hypoxia-inducible factors HIF-1alpha and HIF-2alpha in normal human tissues, cancers, and tumor-associated macrophages (англ.) // The American Journal of Pathology : journal. — 2000. — August (vol. 157, no. 2). — P. 411—421. — doi:10.1016/s0002-9440(10)64554-3. — PMID 10934146. — PMC 1850121.
- ↑ 1 2 3 Bos R., van der Groep P., Greijer A.E., Shvarts A., Meijer S., Pinedo H.M., Semenza G.L., van Diest P.J., van der Wall E. Levels of hypoxia-inducible factor-1alpha independently predict prognosis in patients with lymph node negative breast carcinoma (англ.) // Cancer (журнал) : journal. — Wiley-Blackwell, 2003. — March (vol. 97, no. 6). — P. 1573—1581. — doi:10.1002/cncr.11246. — PMID 12627523.
- ↑ 1 2 Vaupel P., Mayer A. Hypoxia in cancer: significance and impact on clinical outcome (англ.) // Cancer Metastasis Reviews : journal. — 2007. — June (vol. 26, no. 2). — P. 225—239. — doi:10.1007/s10555-007-9055-1. — PMID 17440684.
- ↑ 1 2 Zhong H., De Marzo A.M., Laughner E., Lim M., Hilton D.A., Zagzag D., Buechler P., Isaacs W.B., Semenza G.L., Simons J.W. Overexpression of hypoxia-inducible factor 1alpha in common human cancers and their metastases (англ.) // Cancer Research (журнал) : journal. — American Association for Cancer Research, 1999. — November (vol. 59, no. 22). — P. 5830—5835. — PMID 10582706.
- ↑ 1 2 Aebersold D.M., Burri P., Beer K.T., Laissue J., Djonov V., Greiner R.H., Semenza G.L. Expression of hypoxia-inducible factor-1alpha: a novel predictive and prognostic parameter in the radiotherapy of oropharyngeal cancer (англ.) // Cancer Research (журнал) : journal. — American Association for Cancer Research, 2001. — April (vol. 61, no. 7). — P. 2911—2916. — PMID 11306467.
- ↑ Höckel M., Vaupel P. Tumor hypoxia: definitions and current clinical, biologic, and molecular aspects (англ.) // Journal of the National Cancer Institute : journal. — 2001. — February (vol. 93, no. 4). — P. 266—276. — doi:10.1093/jnci/93.4.266. — PMID 11181773.
- ↑ Dvorák K. Intravenous systemic thrombolysis using streptokinase in the treatment of developing cardiogenic shock in myocardial infarct (Czech) // Vnitr̆ní Lékar̆ství. — 1990. — Май (т. 36, № 5). — С. 426—434. — PMID 2375073.
- ↑ 1 2 Birner P., Schindl M., Obermair A., Breitenecker G., Oberhuber G. Expression of hypoxia-inducible factor 1alpha in epithelial ovarian tumors: its impact on prognosis and on response to chemotherapy (англ.) // Clinical Cancer Research : journal. — 2001. — June (vol. 7, no. 6). — P. 1661—1668. — PMID 11410504.
- ↑ Bos R., Zhong H., Hanrahan C.F., Mommers E.C., Semenza G.L., Pinedo H.M., Abeloff M.D., Simons J.W., van Diest P.J., van der Wall E. Levels of hypoxia-inducible factor-1 alpha during breast carcinogenesis (англ.) // Journal of the National Cancer Institute : journal. — 2001. — February (vol. 93, no. 4). — P. 309—314. — doi:10.1093/jnci/93.4.309. — PMID 11181778.
- ↑ 1 2 Zagzag D., Zhong H., Scalzitti J.M., Laughner E., Simons J.W., Semenza G.L. Expression of hypoxia-inducible factor 1alpha in brain tumors: association with angiogenesis, invasion, and progression (англ.) // Cancer (журнал) : journal. — Wiley-Blackwell, 2000. — June (vol. 88, no. 11). — P. 2606—2618. — doi:10.1002/1097-0142(20000601)88:11<2606::aid-cncr25>3.0.co;2-w. — PMID 10861440.
- ↑ Neufeld G., Kessler O., Vadasz Z., Gluzman-Poltorak Z. The contribution of proangiogenic factors to the progression of Malignancy disease: role of vascular endothelial growth factor and its receptors (англ.) // Surgical Oncology Clinics of North America : journal. — 2001. — April (vol. 10, no. 2). — P. 339—356. — PMID 11382591.
- ↑ 1 2 Powis G., Kirkpatrick L. Hypoxia inducible factor-1alpha as a cancer drug target (англ.) // Molecular Cancer Therapeutics : journal. — 2004. — May (vol. 3, no. 5). — P. 647—654. — PMID 15141023.
- ↑ Pietsch T., Valter M.M., Wolf H.K., von Deimling A., Huang H.J., Cavenee W.K., Wiestler O.D. Expression and distribution of vascular endothelial growth factor protein in human brain tumors (англ.) // Acta Neuropathologica : journal. — 1997. — February (vol. 93, no. 2). — P. 109—117. — doi:10.1007/s004010050591. — PMID 9039457.
- ↑ 1 2 Krieg M., Haas R., Brauch H., Acker T., Flamme I., Plate K.H. Up-regulation of hypoxia-inducible factors HIF-1alpha and HIF-2alpha under normoxic conditions in renal carcinoma cells by von Hippel-Lindau tumor suppressor gene loss of function (англ.) // Oncogene (журнал) : journal. — 2000. — November (vol. 19, no. 48). — P. 5435—5443. — doi:10.1038/sj.onc.1203938. — PMID 11114720.
- ↑ Zundel W., Schindler C., Haas-Kogan D., Koong A., Kaper F., Chen E., Gottschalk A.R., Ryan H.E., Johnson R.S., Jefferson A.B., Stokoe D., Giaccia A.J. Loss of PTEN facilitates HIF-1-mediated gene expression (англ.) // Genes & Development : journal. — 2000. — February (vol. 14, no. 4). — P. 391—396. — PMID 10691731. — PMC 316386.
- ↑ Birner P., Schindl M., Obermair A., Breitenecker G., Oberhuber G. Expression of hypoxia-inducible factor 1alpha in epithelial ovarian tumors: its impact on Prognosis and on response to chemotherapy (англ.) // Clinical Cancer Research : journal. — 2001. — June (vol. 7, no. 6). — P. 1661—1668. — PMID 11410504.
- ↑ Koukourakis M.I., Giatromanolaki A., Skarlatos J., Corti L., Blandamura S., Piazza M., Gatter K.C., Harris A.L. Hypoxia inducible factor (HIF-1a and HIF-2a) expression in early esophageal cancer and response to photodynamic therapy and radiotherapy (англ.) // Cancer Research (журнал) : journal. — American Association for Cancer Research, 2001. — March (vol. 61, no. 5). — P. 1830—1832. — PMID 11280732.
- ↑ Liu, X. Q6, a novel hypoxia-targeted drug, regulates hypoxia-inducible factor signaling via an autophagy-dependent mechanism in hepatocellular carcinoma (англ.) // Autophagy (журнал). — Taylor & Francis, 2014. — Vol. 10. — P. 111—122. — doi:10.4161/auto.26838. — PMID 24220190. — PMC 4389865.
- ↑ Hogenesch J.B., Gu Y.Z., Jain S., Bradfield C.A. The basic-helix-loop-helix-PAS orphan MOP3 forms transcriptionally active complexes with circadian and hypoxia factors (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1998. — May (vol. 95, no. 10). — P. 5474—5479. — doi:10.1073/pnas.95.10.5474. — PMID 9576906. — PMC 20401.
- ↑ Woods S.L., Whitelaw M.L. Differential activities of murine single minded 1 (SIM1) and SIM2 on a hypoxic response element. Cross-talk between basic helix-loop-helix/per-Arnt-Sim homology transcription factors (англ.) // Journal of Biological Chemistry : journal. — 2002. — March (vol. 277, no. 12). — P. 10236—10243. — doi:10.1074/jbc.M110752200. — PMID 11782478.
- ↑ Ema M., Hirota K., Mimura J., Abe H., Yodoi J., Sogawa K., Poellinger L., Fujii-Kuriyama Y. Molecular mechanisms of transcription activation by HLF and HIF1alpha in response to hypoxia: their stabilization and redox signal-induced interaction with CBP/p300 (англ.) // The EMBO Journal : journal. — 1999. — April (vol. 18, no. 7). — P. 1905—1914. — doi:10.1093/emboj/18.7.1905. — PMID 10202154. — PMC 1171276.
- ↑ Bhattacharya S., Michels C.L., Leung M.K., Arany Z.P., Kung A.L., Livingston D.M. Functional role of p35srj, a novel p300/CBP binding protein, during transactivation by HIF-1 (англ.) // Genes & Development : journal. — 1999. — January (vol. 13, no. 1). — P. 64—75. — doi:10.1101/gad.13.1.64. — PMID 9887100. — PMC 316375.
- ↑ 1 2 3 Park Y.K., Ahn D.R., Oh M., Lee T., Yang E.G., Son M., Park H. Nitric oxide donor, (+/-)-S-nitroso-N-acetylpenicillamine, stabilizes transactive hypoxia-inducible factor-1alpha by inhibiting von Hippel-Lindau recruitment and asparagine hydroxylation (англ.) // Molecular Pharmacology : journal. — 2008. — July (vol. 74, no. 1). — P. 236—245. — doi:10.1124/mol.108.045278. — PMID 18426857.
- ↑ Freedman S.J., Sun Z.Y., Poy F., Kung A.L., Livingston D.M., Wagner G., Eck M.J. Structural basis for recruitment of CBP/p300 by hypoxia-inducible factor-1 alpha (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2002. — April (vol. 99, no. 8). — P. 5367—5372. — doi:10.1073/pnas.082117899. — PMID 11959990. — PMC 122775.
- ↑ 1 2 Mahon P.C., Hirota K., Semenza G.L. FIH-1: a novel protein that interacts with HIF-1alpha and VHL to mediate repression of HIF-1 transcriptional activity (англ.) // Genes & Development : journal. — 2001. — October (vol. 15, no. 20). — P. 2675—2686. — doi:10.1101/gad.924501. — PMID 11641274. — PMC 312814.
- ↑ 1 2 Chen D., Li M., Luo J., Gu W. Direct interactions between HIF-1 alpha and Mdm2 modulate p53 function (англ.) // Journal of Biological Chemistry : journal. — 2003. — April (vol. 278, no. 16). — P. 13595—13598. — doi:10.1074/jbc.C200694200. — PMID 12606552.
- ↑ 1 2 Ravi R., Mookerjee B., Bhujwalla Z.M., Sutter C.H., Artemov D., Zeng Q., Dillehay L.E., Madan A., Semenza G.L., Bedi A. Regulation of tumor angiogenesis by p53-induced degradation of hypoxia-inducible factor 1alpha (англ.) // Genes & Development : journal. — 2000. — January (vol. 14, no. 1). — P. 34—44. — doi:10.1101/gad.14.1.34. — PMID 10640274. — PMC 316350.
- ↑ 1 2 3 Kim B.Y., Kim H., Cho E.J., Youn H.D. Nur77 upregulates HIF-alpha by inhibiting pVHL-mediated degradation (англ.) // Experimental and Molecular Medicine : journal. — 2008. — February (vol. 40, no. 1). — P. 71—83. — doi:10.3858/emm.2008.40.1.71. — PMID 18305400. — PMC 2679322.
- ↑ Hansson L.O., Friedler A., Freund S., Rudiger S., Fersht A.R. Two sequence motifs from HIF-1alpha bind to the DNA-binding site of p53 (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2002. — August (vol. 99, no. 16). — P. 10305—10309. — doi:10.1073/pnas.122347199. — PMID 12124396. — PMC 124909.
- ↑ An W.G., Kanekal M., Simon M.C., Maltepe E., Blagosklonny M.V., Neckers L.M. Stabilization of wild-type p53 by hypoxia-inducible factor 1alpha (англ.) // Nature : journal. — 1998. — March (vol. 392, no. 6674). — P. 405—408. — doi:10.1038/32925. — PMID 9537326.
- ↑ Cho S., Choi Y.J., Kim J.M., Jeong S.T., Kim J.H., Kim S.H., Ryu S.E. Binding and regulation of HIF-1alpha by a subunit of the proteasome complex, PSMA7 (англ.) // FEBS Letters : journal. — 2001. — June (vol. 498, no. 1). — P. 62—6. — doi:10.1016/S0014-5793(01)02499-1. — PMID 11389899.
- ↑ 1 2 Jung J.E., Kim H.S., Lee C.S., Shin Y.J., Kim Y.N., Kang G.H., Kim T.Y., Juhnn Y.S., Kim S.J., Park J.W., Ye S.K., Chung M.H. STAT3 inhibits the degradation of HIF-1alpha by pVHL-mediated ubiquitination (англ.) // Experimental and Molecular Medicine : journal. — 2008. — October (vol. 40, no. 5). — P. 479—485. — doi:10.3858/emm.2008.40.5.479. — PMID 18985005. — PMC 2679355.
- ↑ 1 2 André H., Pereira T.S. Identification of an alternative mechanism of degradation of the hypoxia-inducible factor-1alpha (англ.) // Journal of Biological Chemistry : journal. — 2008. — October (vol. 283, no. 43). — P. 29375—29384. — doi:10.1074/jbc.M805919200. — PMID 18694926. — PMC 2662024.
- ↑ Corn P.G., McDonald E.R., Herman J.G., El-Deiry W.S. Tat-binding protein-1, a component of the 26S proteasome, contributes to the E3 ubiquitin ligase function of the von Hippel-Lindau protein (англ.) // Nature Genetics : journal. — 2003. — November (vol. 35, no. 3). — P. 229—237. — doi:10.1038/ng1254. — PMID 14556007.
- ↑ Li Z., Wang D., Na X., Schoen S.R., Messing E.M., Wu G. The VHL protein recruits a novel KRAB-A domain protein to repress HIF-1alpha transcriptional activity (англ.) // The EMBO Journal : journal. — 2003. — April (vol. 22, no. 8). — P. 1857—1867. — doi:10.1093/emboj/cdg173. — PMID 12682018. — PMC 154465.
- ↑ Tanimoto K., Makino Y., Pereira T., Poellinger L. Mechanism of regulation of the hypoxia-inducible factor-1 alpha by the von Hippel-Lindau tumor suppressor protein (англ.) // The EMBO Journal : journal. — 2000. — August (vol. 19, no. 16). — P. 4298—4309. — doi:10.1093/emboj/19.16.4298. — PMID 10944113. — PMC 302039.
- ↑ Min J.H., Yang H., Ivan M., Gertler F., Kaelin W.G., Pavletich N.P. Structure of an HIF-1alpha -pVHL complex: hydroxyproline recognition in signaling (англ.) // Science : journal. — 2002. — June (vol. 296, no. 5574). — P. 1886—1889. — doi:10.1126/science.1073440. — PMID 12004076.
- ↑ Yu F., White S.B., Zhao Q., Lee F.S. HIF-1alpha binding to VHL is regulated by stimulus-sensitive proline hydroxylation (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2001. — August (vol. 98, no. 17). — P. 9630—9635. — doi:10.1073/pnas.181341498. — PMID 11504942. — PMC 55503.
- ↑ Haase V.H. The VHL tumor suppressor: master regulator of HIF (англ.) // Current Pharmaceutical Design : journal. — 2009. — Vol. 15, no. 33. — P. 3895—3903. — doi:10.2174/138161209789649394. — PMID 19671042. — PMC 3622710.
- ↑ Sun Y.Y. Glucocorticoid protection of oligodendrocytes against excitotoxin involving hypoxia-inducible factor-1alpha in a cell-type-specific manner. (англ.) // The Journal of Neuroscience : journal. — 2010. — Vol. 30, no. 28. — P. 9621—9630. — doi:10.1523/JNEUROSCI.2295-10.2010. — PMID 20631191.
- ↑ Menshanov, Petr N; Bannova, Anita V; Dygalo, Nikolay N. Anoxia ameliorates the dexamethasone-induced neurobehavioral alterations in the neonatal male rat pups (англ.) // Hormones and Behavior : journal. — 2017. — Vol. 87. — P. 122—128. — doi:10.1016/j.yhbeh.2016.11.013. — PMID 27865789.