Нитроглицерин
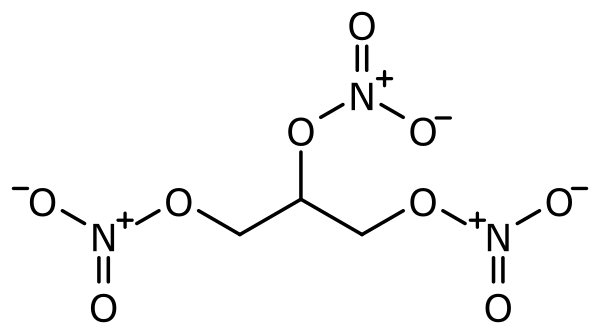
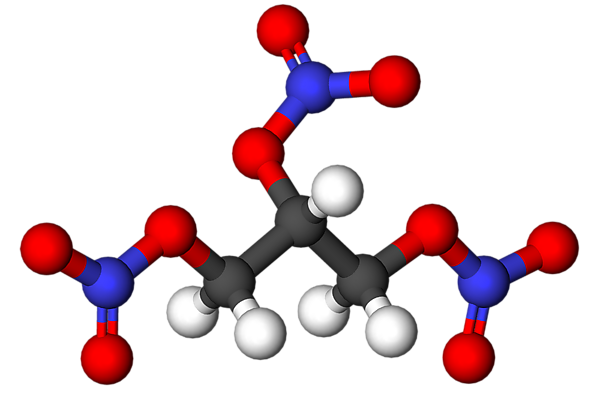
Нитроглицери́н (1,2,3-тринитрооксипропан; также глицеринтринитрат, тринитроглицерин, тринитрин, НГЦ) — органическое соединение, сложный эфир глицерина и азотной кислоты.
В терминах номенклатуры IUPAC имеет наименование 1,2,3-тринитроксипропан. Химическая формула: O2NOCH2CH(ONO2)CH2ONO2.
Широко известен благодаря своим взрывчатым и лекарственным свойствам. Впервые синтезирован итальянским химиком Асканио Собреро в 1847 году, первоначально был назван «пироглицерин» (итал. pyroglycerina).
Что важно знать
| Нитроглицерин | |
|---|---|
| Общие | |
| Систематическое наименование |
1,2,3-тринитроксипропан |
| Сокращения | НГЦ |
| Традиционные названия | нитроглицерин |
| Хим. формула | C3H5N3O9 |
| Физические свойства | |
| Состояние | тяжёлая, маслянистая бесцветная жидкость |
| Молярная масса | 227,0865 ± 0,0061 г/моль |
| Плотность |
1,595 г/см³ (жидкий) 1,735 г/см³ (твердый) |
| Термические свойства | |
| Температура | |
| • плавления | 13 °C |
| • кипения | 160 °C |
| • разложения | 140 ± 1[1] и 122 ± 1[1] |
| • самовоспламенения | 270 °C |
| Давление пара | 0,0003 ± 0,0001[1] |
| Химические свойства | |
| Растворимость | |
| • в воде | 0,138 г/100 мл |
| Классификация | |
| Рег. номер CAS | 55-63-0 |
| 3D model (JSmol) | Интерактивная схема |
| PubChem | 4510 |
| UNII | G59M7S0WS3 |
| CompTox Dashboard EPA | DTXSID1021407 |
| Рег. номер EINECS | 200-240-8 |
| SMILES |
[http://chemapps.stolaf.edu/jmol/jmol.php?model=C%28C%28CO%5BN%2B%5D%28%3DO%29O%3Cbr%3E%0A%5BN%2B%5D%28%3DO%29%5BO-%5D%29O%5BN%2B%5D%28%3DO%29%5BO-%5D C(C(CO[N+](=O)O [N+](=O)[O-])O[N+](=O)[O-]] |
| InChI | |
| RTECS | QX2100000 |
| ChEBI | 28787 |
| Номер ООН | 0143, 0144, 1204, 3064 и 3319 |
| ChemSpider | 4354 |
| ECHA InfoCard | 100.000.219 |
| Безопасность | |
| Предельная концентрация | 0,02 мг/дм3 |
| ЛД50 |
105 мг/кг (крысы, перорально), 115 мг/кг (мыши, перорально), 140 мг/кг (морские свинки, перорально), <210 мг/кг (LD100 человек, перорально) |
| Токсичность | высокотоксичен, взрывоопасен, особенно опасны его пары, при втирании в кожу вызывает сильное и продолжительное отравление. |
| Пиктограммы ECB |
|
| NFPA 704 | |
Физико-химические свойства
Прозрачная вязкая нелетучая жидкость (как масло), склонная к переохлаждению. Смешивается с органическими растворителями, почти нерастворим в воде[2] (0,13 % при 20 °C, 0,2 % при 50 °C, 0,35 % при 80 °C). При нагревании с водой до 80 °C гидролизуется. Быстро разлагается щёлочами.
Очень чувствителен к удару, трению, высоким температурам, резкому нагреву и т. п. Чувствительность к удару для груза 2 кг — 4 см (гремучая ртуть — 2 см, тротил — 100 см). Весьма опасен в обращении. При осторожном поджигании в малых количествах неустойчиво горит синим пламенем. Температура кристаллизации — 13,5 °C (стабильная модификация, лабильная кристаллизуется при 2,8 °C). Кристаллизуется со значительным увеличением чувствительности к трению. При нагревании до 50 °C начинает медленно разлагаться и становится ещё более взрывоопасным. Температура вспышки — около 200 °C.
Теплота взрыва — 6,535 МДж/кг. Температура взрыва — 4110 °C. Скорость детонации — 7650 м/с. 8000—8200 м/c — в стальной трубе диаметром 35 мм, инициирован с помощью детонатора № 8. В обычных условиях жидкий НГЦ часто детонирует в низкоскоростном режиме 1100—2000 м/с. Плотность — 1,595 г/см³, в твёрдом виде — 1,735 г/см³. Твёрдый нитроглицерин менее чувствителен к удару, но более — к трению, поэтому очень опасен. Объём продуктов взрыва — 715 л/кг. Фугасность в песке — 390 мл, в воде — 590 мл (кристаллического несколько выше), работоспособность (фугасность) в свинцовой бомбе — 550 см³.
Применяется как компонент некоторых жидких взрывчатых веществ, динамитов и главным образом бездымных порохов (для пластификации нитратов целлюлозы). Кроме того, в малых концентрациях применяется в медицине.
Получение
В лаборатории получают этерификацией глицерина смесью концентрированной азотной и серной кислот. Для обеспечения безопасности процесса и хорошего выхода по глицерину кислотная смесь должна иметь малое содержание воды[3].
Процесс этерификации проводят при низких температурах, внимательно отслеживая температуру. Уравнение этерификации глицерина азотной кислотой в присутствии серной кислоты можно упрощенно записать следующим образом:
В промышленности получают непрерывным нитрованием глицерина нитрующей смесью в специальных инжекторах. Полученную смесь сразу разделяют в сепараторах (преимущественно системы Биацци[4]). После промывки нитроглицерин используют в виде водной эмульсии, что упрощает и делает более безопасным его транспортировку между цехами. В связи с возможной опасностью взрыва нитроглицерин не хранят, а сразу перерабатывают в бездымный порох или взрывчатые вещества.
Применение
Нитроглицерин относится к категории веществ, называемых вазодилататорами — средствам, понижающим кровяное давление, расслабляет гладкую мускулатуру кровеносных сосудов, бронхов, желчных и мочевых путей, желудочно-кишечного тракта. Основное применение имеет при стенокардии, главным образом для купирования острых приступов спазмов коронарных сосудов. Для предупреждения приступов он мало пригоден из-за кратковременности действия. Иногда применяется при эмболии центральной артерии сетчатки, а также функциональных холецистопатиях.
Нитроглицерин широко применялся во взрывотехнике. В чистом виде он очень неустойчив и опасен. После открытия итальянским химиком Асканио Собреро нитроглицерина, в 1853 году русский химик Николай Николаевич Зинин предложил использовать его в технических целях.
Спустя 10 лет инженер Василий Фомич Петрушевский первым начал производить его в больших количествах, под его руководством нитроглицерин был применён в горном деле в 1867 году. Альфред Нобель в 1863 году изобрёл инжектор-смеситель для производства нитроглицерина и капсюль-детонатор, а в 1867 году — динамит.
- Герой приключенческого романа «Путешествие к центру земли» (1863) Жюля Верна, Отто Лиденброк использует нитроглицерин для подрыва гранитной скалы, чтобы освободить путь к центру земли. Он терпит неудачу поскольку оказывается в проходе ведущему к жерлу вулкана.
- Герой приключенческого романа «Таинственный остров» (1874) Жюля Верна, Сайрес Смит использует нитроглицерин для подрыва гранитной скалы. Автор подробно описывает процесс получения нитроглицерина из природных веществ, обнаруженных на острове (хотя Жюль Верн намеренно опустил один из важных этапов синтеза). Писатель характеризует это вещество следующим образом[5]:
- Основная часть сюжета фильма «Плата за страх» (1953) заключается в процессе перевозки нитроглицерина на грузовиках.
- В сериале «Побег» сезон 2 серия 9 в ботаническом саду находят ящик с ампулами нитроглицерина, который спрятал Майкл Скофилд.
- В сериале «Остаться в живых» сезон 1 серии 24-25 на корабле «Черная скала» находят динамит (нитроглицерин, стабилизированный пористым веществом)
- В фильме «Легенда Зорро» (2005) главный злодей демонстрирует нитроглицерин заказчикам, также финальная сцена фильма происходит в поезде, перевозящем нитроглицерин.
- В телесериале «Мир Дикого запада» захват груза нитроглицерина в эпизоде «Контрапассо» является важным сюжетным элементом[6][7].
- Пятый выпуск передачи канала Discovery «Дикие эксперименты Адама Сэвиджа» целиком посвящен экспериментам с нитроглицерином.
- В аниме и манге Dr. Stone нитроглицерин фигурирует как часть последнего козыря в рукаве главных героев в битве за пещеру, в которой можно добывать азотную кислоту — ключевой ингредиент средства от окаменения.
Токсичность нитроглицерина
Нитроглицерин высокотоксичен. Токсичность нитроглицерина объясняется тем, что он легко и быстро всасывается через кожу и слизистые оболочки (в особенности этому способствует слизистая ротовой полости, дыхательных путей и лёгких) в кровь.
Токсичной дозой для человека считается 25—50 мг.
При отравлении нитроглицерином наблюдается понижение артериальное давление, появляется сильная головная боль, головокружение, покраснение лица, сильное жжение в горле и под «ложечкой», возможна одышка, обморок, нередко наблюдается тошнота, рвота, колики, светобоязнь, недолговременные и проходящие расстройства зрения, параличи (особенно глазных мышц), шум в ушах, биение артерий, замедление пульса, синюшность, похолодание конечностей[8]. Хроническое действие нитроглицерина (хроническое отравление организма нитроглицерином наблюдалось у работников, производящих динамит), вдыхание, а также приём внутрь больших доз (100—150 мг/кг) может привести к летальному исходу.
Нитроглицерин также может вызывать сильное раздражение кожи. У работающих с динамитом развиваются упорные язвы под ногтями и на концах пальцев, высыпания на подошвах и между пальцами рук, сухость кожи и трещины[8].
ПДК нитроглицерина для рабочей зоны составляет 0,02 мг/дм³[9][2]. Класс опасности — 2.
Примечания
Литература
- Григорович П. С., Каменский Д. А., Менделеев Д. И., Чельцов И. М. Нитроглицерин // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Вредные вещества в промышленности : Справочник для химиков, инженеров и врачей : в 3 т. / Под ред. засл. деят. науки проф. Н. В. Лазарева и докт. биол. наук проф. И. Д. Гадаскиной. — Изд. 7-е, пер. и доп. — Л. : «Химия», 1977. — Т. III : Неорганические и элементорганические соединения. — С. 124—126. — 608 с.