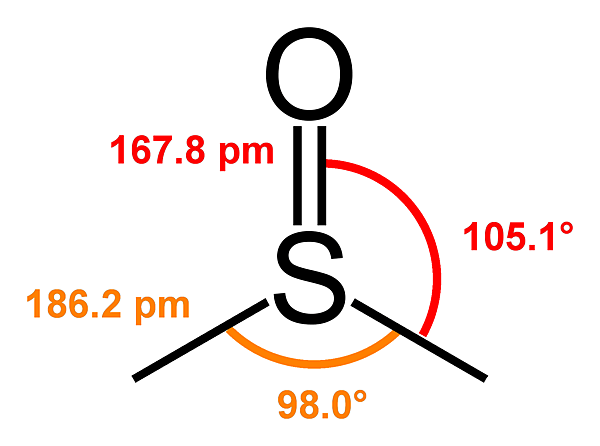
Диметилсульфоксид
Диметилсульфоксид (ДМСО, формула — (CH3)2SO) — химическое вещество со сладковатым вкусом и специфическим запахом)[2].
Первый член гомологического ряда ациклических сульфоксидов R2SO. Является одним из важных биполярных апротонных растворителей[3].
Широко применяется в различных областях химии, биологии (как криопротектор), а также в фарминдустрии (производство лекарственных средств)[4].
Что важно знать
| Диметилсульфоксид | |
|---|---|
| Общие | |
| Систематическое наименование |
диметилсульфоксид |
| Сокращения | DMSO, ДМСО |
| Хим. формула | C2H6OS |
| Физические свойства | |
| Состояние | жидкость |
| Молярная масса | 78,13 г/моль |
| Плотность | 1,1004 г/см³ |
| Динамическая вязкость | 0,001996 Па·с |
| Термические свойства | |
| Температура | |
| • плавления | 18,5 °C |
| • кипения | 189 °C |
| Химические свойства | |
| Константа диссоциации кислоты | -35,1[1] |
| Растворимость | |
| • в воде | неограниченная |
| • в этаноле | неограниченная |
| • в бензоле | неограниченная |
| • в хлороформе | неограниченная |
| • в диэтиловом эфире | не растворяется |
| Структура | |
| Дипольный момент | 3,96 Д |
| Классификация | |
| Рег. номер CAS | 67-68-5 |
| 3D model (JSmol) | Интерактивная схема |
| PubChem | 679 |
| UNII | YOW8V9698H |
| CompTox Dashboard EPA | DTXSID2021735 |
| Рег. номер EINECS | 200-664-3 |
| SMILES | |
| InChI | |
| RTECS | PV6210000 |
| ChEBI | 28262 |
| ChemSpider | 659 |
| ECHA InfoCard | 100.000.604 |
| Безопасность | |
| NFPA 704 | |
История
Диметилсульфоксид впервые синтезирован в 1866 году российским химиком Александром Зайцевым (учеником А. М. Бутлерова) путём окисления диметилсульфида азотной кислотой. В течение нескольких последующих десятилетий исследования свойств этого химического вещества не проводились, а учёные не проявляли к нему особого интереса[5].
В 1958 году была обнаружена уникальная способность диметилсульфоксида растворять многие неорганические и органические соединения, за что его в Советском Союзе называли «сверхрастворителем»[2].
С 1960 года в СССР было налажено производство этого химического вещества в промышленных масштабах в качестве универсального растворителя и основы для лекарственных средств, используемых в медицинской практике[6].
В Европе и США с 1960-х годов диметилсульфоксид использовали в качестве промышленного растворителя и для криоконсервации тканей. В 1963 году Управление по санитарному надзору за качеством пищевых продуктов и лекарственных средств США (FDA) одобрило первые клинические исследования химического вещества как основы для ряда лекарственных препаратов. В 2009 году FDA впервые одобрил лекарственное средство (нестероидный противовоспалительный препарат), в составе которого был ДМСО[2].
Получение
Одним из основных способов получения диметилсульфоксида является окисление диметилсульфида. В промышленных масштабах этот процесс проводят с использованием азотной кислоты[5].
Это химическое вещество представляет собой побочный продукт целлюлозно-бумажной промышленности. По данным на 2021 год, годовое производство диметилсульфоксида измеряется десятками тысяч тонн[2].
В лабораторных условиях для мягкого и селективного окисления диметилсульфида может быть использован периодат калия. Однако подобные лабораторные способы получения диметилсульфоксида не имеют практической значимости. Это обусловлено низкой коммерческой стоимостью готового растворителя[3].
Физические и химические свойства
Сульфоксиды являются бесцветными гигроскопичными жидкими или кристаллическими веществами[4].
Диметилсульфоксид обладает высокой плотностью и остаточной термической стойкостью, слабо токсичен, и не является коррозионным агентом. Главное преимущество этого химического вещества — его высокая растворяющая способность, что позволяет проводить процесс экстракции при низких кратностях растворителя к сырью и температурах (30 °С)[3].
К недостаткам диметилсульфоксида следует отнести высокую точку замерзания растворителя (+18,4 °С) и низкую избирательность разделения. При смешивании с водой образуемый раствор нагревается. При взаимодействии с сильными минеральными кислотами образует соли[6].
Диметилсульфоксид особо прозрачен — до ~260 нм. Он вступает в химические реакции с иодистым метилом, образуя ион сульфоксония, способный к взаимодействию с гидридом натрия[7].
Применение
Диметилсульфоксид — важный биполярный апротонный растворитель. Благодаря своей сильной растворяющей способности, он используется как растворитель в химических реакциях с участием неорганических солей, в частности в реакциях нуклеофильного замещения[5].
Кислотные свойства этого химического вещества выражены слабо, поэтому оно стало важным растворителем в химии карбанионов. Измерены значения неводных pKa для сотен органических соединений[1].
Из-за высокой температуры кипения диметилсульфоксид крайне медленно испаряется при нормальном атмосферном давлении, что делает его лучшим растворителем для проведения реакций при нагревании. В то же время, довольно высокая температура плавления ограничивает его применение в области низких температур. После проведения реакции, реакционные смеси чаще всего разбавляют водой для осаждения органических веществ. Дейтерированная форма диметилсульфоксида (ДМСО-d6), является удобным растворителем для ЯМР-спектроскопии[3].
В качестве растворителя диметилсульфоксид используется для устранения пятен краски (его эффективность существенно выше, чем бензина или дихлорметана). Наряду с нитрометаном, диметилсульфоксид также является средством, удаляющим «супер-клей» и не застывшую монтажную пену. Эффективно используется он и в производстве микроэлектроники[8].
Диметилсульфоксид используется в ПЦР для ингибирования спаривания исходных молекул ДНК. Перед началом реакции он добавляется к ПЦР-смеси и взаимодействует с комплементарными участками ДНК, препятствуя их спариванию и уменьшая количество побочных процессов[7].
Диметилсульфоксид широко применяется в медицине в качестве криопротектора (в трансплантологии)[2]. Он добавляется в клеточную среду для предотвращения повреждения клеток при их заморозке. Раствор диметилсульфоксида используется для безопасного охлаждения клеток и их хранения[9].
В качестве лекарственного средства очищенный диметилсульфоксид (торговое название препарата — «Димексид») применяется в виде водных растворов (10-50 %), как местное противовоспалительное и обезболивающее средство[2]. Кроме того, он входит в состав большинства мазей для увеличения трансдермального переноса действующих веществ, поскольку за несколько секунд способен проникать через кожу в мягкие ткани и переносить любые другие вещества[5].
Токсичность
Раствор диметилсульфоксида в малой концентрации, в отличие от других ациклических сульфоксидов, таких как: диметилформамид, диметилацетамид, ГМФТА, не является токсичным[10]. Кроме того, диметилсульфоксид не обладает эмбриотоксичностью, поэтому используется в качестве идеального криоконсерванта для спермы и эмбрионов. Однако при его сгорании выделяется ядовитый серни́стый газ[11].
См. также
Примечания
Литература
- Гордон А. М., Форд Р. С. Спутник химика. — 2-е изд.,. — М.: Русские словари, Астрель, АСТ, 2002. — 512 с. — ISBN 5-17-001389-2.
- Несмеянов А. Н., пер. Е. Л. Розенберга, С. И. Коппель. Начало органической химии.. — М.: Мир, 1976. — 544 с.. — 211 с.