Ацетальдегид
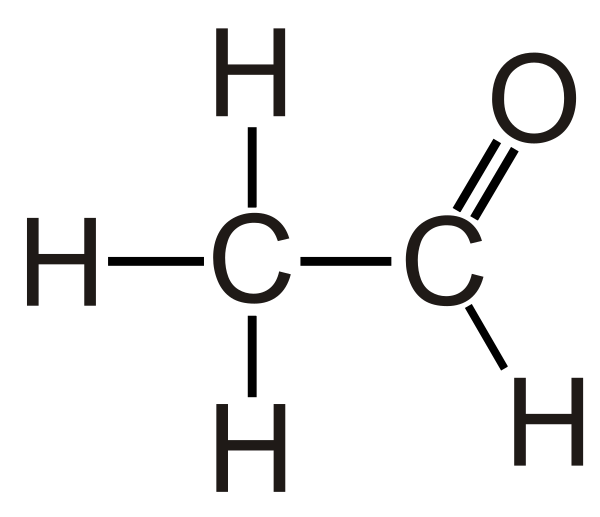
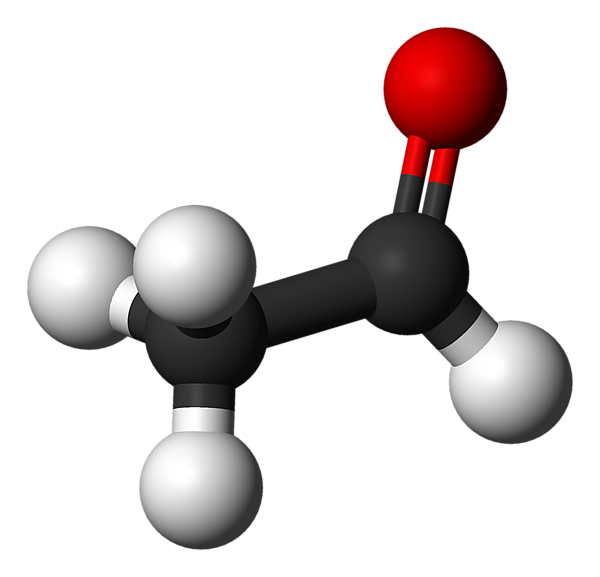
Ацетальдеги́д (у́ксусный альдегид, этана́ль, в просторечии - альдоцит, химическая формула — С2H4O или СH3СHO) — органическое соединение, относящееся к классу альдегидов. Является альдегидом этанола и уксусной кислоты.
При стандартных условиях, ацетальдегид — это бесцветная жидкость с резким запахом. Умеренно токсичен, является ирритантом и опасен для окружающей среды.
Что важно знать
| Ацетальдегид | |
|---|---|
| Общие | |
| Систематическое наименование |
Этаналь |
| Традиционные названия | Ацетальдегид, метилформальдегид, уксусный альдегид, "альдоцит" |
| Хим. формула |
С2H4O |
| Рац. формула | СH3СHO |
| Физические свойства | |
| Состояние | Жидкость |
| Молярная масса | 44,0526 ± 0,0022 г/моль |
| Плотность | 0,784 г/см³ |
| Динамическая вязкость | ~0,215 при 20 °C |
| Энергия ионизации | 10,22 ± 0,01[1] |
| Термические свойства | |
| Температура | |
| • плавления | −123,37 °C |
| • кипения | 20,2 °C |
| • вспышки | −36 ± 1[1] |
| • воспламенения | 234,15 K (−39 °C) °C |
| • самовоспламенения | 458,15 K (185 °C) °C |
| Пределы взрываемости | 4-60 % |
| Критическая точка | 192,85 |
| Энтальпия | |
| • образования | -166 кДж/моль |
| Давление пара | 2,7650; 4,8670; 10,0100 [2] атм |
| Химические свойства | |
| Константа диссоциации кислоты | 13,57 (25 °C) |
| Растворимость | |
| • в воде | С водой и этанолом смешивается во всех соотношениях. |
| Оптические свойства | |
| Показатель преломления | 1,3316 |
| Структура | |
| Дипольный момент | 2,750 ± 0,006 Д |
| Классификация | |
| Рег. номер CAS | 75-07-0 |
| 3D model (JSmol) | Интерактивная схема |
| PubChem | 177 |
| UNII | GO1N1ZPR3B |
| CompTox Dashboard EPA | DTXSID5039224 |
| Рег. номер EINECS | 200-836-8 |
| SMILES | |
| InChI | |
| RTECS | AB1925000 |
| ChEBI | 15343 |
| Номер ООН | 1089 |
| ChemSpider | 172 |
| ECHA InfoCard | 100.000.761 |
| Безопасность | |
| Предельная концентрация | 5 мг/м3 |
| ЛД50 |
1232 мг/кг (мыши, внутрижелудочно), 900 мг/кг (мыши, перорально), 661 мг/кг (крысы, перорально) |
| Токсичность | умеренно токсичен, ирритант, опасен для окружающей среды |
| Пиктограммы ECB |
|
| NFPA 704 | |
Нахождение в природе
Ацетальдегид широко встречается в природе, например, он встречается в кофе, в спелых фруктах, хлебе, и синтезируется растениями в процессе их метаболизма.[источник?]
Физические свойства
Вещество представляет собой бесцветную ядовитую жидкость при стандартных условиях (0 °C), бесцветный газ с резким запахом, похожим на запах прелых яблок при комнатной температуре (25 °C), хорошо растворяется в воде, спирте, эфире. Из-за очень низкой температуры кипения (20,2 °C) хранят и перевозят ацетальдегид в виде тримера — паральдегида, из которого он может быть получен нагреванием с минеральными кислотами (обычно серной).
Химические свойства
По своим химическим свойствам уксусный альдегид является типичным алифатическим альдегидом, и для него характерны реакции этого класса соединений. Его реакционная способность определяется двумя факторами: активностью карбонила альдегидной группы и подвижностью атомов водорода метильной группы, вследствие индуктивного эффекта карбонила.
Подобно другим карбонильным соединениям с атомами водорода у α-углеродного атома, ацетальдегид таутомеризируется, образуя енол — виниловый спирт, равновесие почти полностью смещено в сторону альдегидной формы (константа равновесия — только 6⋅10−5 при комнатной температуре[3]):
Из-за небольших размеров молекулы и доступности в виде безводного мономера (в отличие от формальдегида) ацетальдегид является широко распространённым электрофильным агентом в органическом синтезе[4]. Что касается реакций конденсации, альдегид прохирален. Он используется, в основном, как источник синтона «CH3C+H(OH)» в альдольной и соответствующих реакциях конденсации. Реактив Гриньяра и литий-органические соединения реагируют с MeCHO, образуя производные гидроксиэтила. В одной из реакций конденсации, три эквивалента формальдегида присоединяются, а один восстанавливает образующийся альдегид, образуя из MeCHO пентаэритрит (C(CH2OH)4.)
В реакции Штрекера[5] ацетальдегид конденсируется с цианидом и аммиаком, образуя после гидролиза аминокислоту — аланин[6]. Ацетальдегид способен конденсироваться с аминами образуя имины, так как конденсация циклогексиламина даёт N-этилиден циклогексиламин. Эти имины могут быть использованы для прямой последующей реакции, таких, как альдольная конденсация[7].
Ацетальдегид также — важный строительный блок для синтезов гетероциклических соединений. Выдающийся пример — конверсия под действием аммиака до 5-этил-2-метилпиридина («альдегид-коллидин»)[8]
Реакция альдольной конденсации обусловлена подвижностью водорода в альфа-положении в радикале и осуществляется в присутствии разбавленных щелочей. Её можно рассматривать как реакцию нуклеофильного присоединения одной молекулы альдегида к другой:
Три молекулы ацетальдегида конденсируются, образуя «паральдегид» — циклический тример, содержащий одиночные С-О связи. Конденсация четырёх молекул даёт циклическое соединение, называемое метальдегид.
Ацетальдегид образует стабильные ацетали при реакции с этанолом в условиях дегидратации. Продукт CH3CH(OCH2CH3)2 называется «ацеталь»[9], хотя термин используется для описания более широкой группы соединений с общей формулой RCH(OR')2.
Получение
В 2003 году, глобальное производство ацетальдегида составляло около миллиона тонн в год.
Ацетальдегид получают следующими способами:
1) Окисление этилена (Вакер-процесс):
В качестве окислителя в Вакер-процессе используется хлорид палладия, регенерирующийся окислением хлоридом меди в присутствии кислорода воздуха:
2) Гидратация ацетилена в присутствии солей ртути (реакция Кучерова), с образованием енола, изомеризующегося в альдегид:
3) Окисление или дегидрирование этилового спирта, на медном или серебряном катализаторе (данный способ получения доминировал до открытия Вакер-процесса):
Применение
Ацетальдегид применяют для получения уксусной кислоты, бутадиена, некоторых органических веществ и альдегидных полимеров.
Ранее ацетальдегид, в основном, использовался в качестве прекурсора к уксусной кислоте. Такое применение было отвергнуто ввиду того, что уксусная кислота более эффективно производилась из метанола при помощи процессов Монсанто[10] и Катива[11]. В терминах реакции конденсации, ацетальдегид — важный прекурсор к пиридиновым производным, пентаэритролу и кротональдегиду. Мочевина и ацетальдегид конденсируются, образуя смолы. Уксусный ангидрид реагирует с ацетальдегидом, давая этилидендиацетат, из которого получают винилацетат — мономер поливинилацетата.
Биохимия
В печени имеется фермент алкогольдегидрогеназа, который окисляет этанол в ацетальдегид, который затем окисляется в безопасную уксусную кислоту посредством ацетальдегиддегидрогеназы. Эти две реакции окисления связаны с восстановлением NAD+ в NADH[12]. В мозгу алкогольдегидрогеназа не играет особой роли в окислении этанола в ацетальдегид, это делает энзим каталаза. Конечные шаги алкогольной ферментации в бактериях, растениях и дрожжах включают конверсию пирувата в ацетальдегид под действием пируватдекарбоксилазы, после чего — конверсию ацетальдегида в этанол. Последняя реакция снова катализируется алкогольдегидрогеназой, но уже в обратном направлении.
Ацетальдегид — значительная часть дыма табака. Была продемонстрирована синергическая связь с никотином, увеличивающая появление зависимости, особенно у молодёжи.[13][14]
Люди, у которых отсутствует генетический фактор конверсии ацетальдегида в уксусную кислоту, могут иметь большой риск предрасположенности к болезни Альцгеймера. «Эти результаты указывают, что отсутствие ALDH2 — это фактор риска для поздно возникающей болезни Альцгеймера.»[15]
Ацетальдегид, полученный из поглощённого этанола, связывает ферменты, образуя аддукты, связанные с заболеваниями органов.[16] Лекарство дисульфирам (Antabuse) предотвращает окисление ацетальдегида до уксусной кислоты. Это даёт неприятные ощущения при принятии алкоголя. Antabuse используется в случае, когда алкоголик сам хочет излечиться.
Ацетальдегид является канцерогеном первой группы.[17][18] «Существует достаточно доказательств канцерогенности ацетальдегида (основного метаболита этанола) в экспериментах на животных», кроме того, ацетальдегид повреждает ДНК[19] и вызывает несоразмерное с общей массой тела развитие мускулов, связанное с нарушением белкового равновесия организма.[20] В результате исследования 818 алкоголиков ученые пришли к выводу, что у тех пациентов, которые подвергались действию ацетальдегида в большей степени, присутствует дефект в гене фермента алкогольдегидрогеназы. Поэтому такие пациенты подвержены большему риску развития рака верхней части ЖКТ и печени.[21]
Ацетальдегид[22] токсичен при действии на кожу, ирритант, канцероген[нет в источнике]. Однако токсичность ацетальдегида намного ниже, чем у формальдегида, например, потому что ацетальдегид в организме быстро окисляется до безвредной уксусной кислоты. Он также является загрязнителем воздуха при горении, курении, в автомобильных выхлопах. Кроме того, этаналь образуется при термической обработке полимеров и пластиков.[23]
При длительном контакте с воздухом могут образоваться перекиси, и произойти взрыв, который может разрушить ёмкость[24]
- Кожа: Использование адекватной защитной одежды для предотвращения контакта с кожей.
- Глаза: Использование адекватных средств индивидуальной защиты (СИЗ) глаз
- Переодевание: При намокании (из-за пожароопасности)
- Рекомендации: Установить фонтанчики для промывки глаз, оборудовать места для быстрого переодевания
По данным[25] ПДК ацетальдегида в воздухе рабочей зоны 5 мг/м3 , в атмосферном воздухе 0,01 мг/м3 [26] В то же время, по данным[27] порог восприятия запаха этого вещества может достигать, например, 1800 мг/м3.
Одним из механизмов врожденной непереносимости алкоголя является накопление ацетальдегида.











![{\displaystyle {\mathsf {C_{2}H_{2}+H_{2}O{\xrightarrow[{}]{Hg^{2+},H^{+}}}CH_{3}CHO}}}](https://ru.ruwiki.ru/api/rest_v1/media/math/render/svg/a182f66624c2c00dce96a4b175c3d2deb68bb8f8)
![{\displaystyle {\mathsf {C_{2}H_{5}OH{\xrightarrow[{}]{Ag,^{o}C}}CH_{3}CHO+H_{2}}}}](https://ru.ruwiki.ru/api/rest_v1/media/math/render/svg/1e7aa9638121dda4cf1eb3f0f44d887d3fa91dbb)
![{\displaystyle {\mathsf {2C_{2}H_{5}OH+O_{2}{\xrightarrow[{}]{Ag,^{o}C}}2CH_{3}CHO+2H_{2}O}}}](https://ru.ruwiki.ru/api/rest_v1/media/math/render/svg/33a80be048d2a2f469b931d82ebcfc2fe9539c5c)