Этиленгликоль
Этилéнглико́ль (1,2-дигидрооксиэтан[5], 1,2-диоксиэтан, этандиол-1,2), HO—CH2—CH2—OH — кислородсодержащее органическое соединение, двухатомный спирт, один из представителей полиолов (многоатомных спиртов). В очищенном виде представляет собой прозрачную бесцветную жидкость слегка маслянистой консистенции. Не имеет запаха и обладает сладковатым вкусом.
Не проявляет коррозионной активности к алюминию и нержавеющим сталям. Вещество токсично, взрыво- и пожароопасно. Случайный приём внутрь этиленгликоля в больших концентрациях[6] может привести к отравлению[7].
Что важно знать
| Этиленгликоль | |
|---|---|
| Общие | |
| Систематическое наименование |
этандиол-1,2 |
| Традиционные названия |
1,2-дигидроксиэтан, этиленгликоль, 1,2-диоксиэтан, 1,2-этандиол |
| Хим. формула | C2H6O2 |
| Рац. формула | C2H4(OH)2 |
| Физические свойства | |
| Состояние | бесцветная жидкость без запаха, со сладковатым вкусом |
| Молярная масса | 62,068 г/моль |
| Плотность | 1,113 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | −12,9 °C |
| • кипения | 197,3 °C |
| • вспышки | 111 °C |
| Пределы взрываемости | 3,2 ± 0,1[3] |
| Энтальпия | |
| • кипения | 50,5[1] и 57,4[2] |
| Давление пара | 7900[4] |
| Химические свойства | |
| Константа диссоциации кислоты | 15,1 ± 0,1[4] |
| Оптические свойства | |
| Показатель преломления | 1,4318 |
| Классификация | |
| Рег. номер CAS | 107-21-1 |
| 3D model (JSmol) | Интерактивная схема |
| PubChem | 174 |
| UNII | FC72KVT52F |
| CompTox Dashboard EPA | DTXSID8020597 |
| Рег. номер EINECS | 203-473-3 |
| SMILES | |
| InChI | |
| RTECS | KW2975000 |
| ChEBI | 30742 |
| ChemSpider | 13835235 |
| ECHA InfoCard | 100.003.159 |
| Безопасность | |
| Предельная концентрация | 5 мг/м3 |
| ЛД50 | 470 мг/кг (крысы, перорально) |
| Токсичность | обладает общетоксическим действием |
| Фразы риска (R) | R22 |
| Краткие характер. опасности (H) |
H302 |
| Меры предостор. (P) |
P264, P270, P301+P312, P330, P501 |
| Пиктограммы СГС |
|
| NFPA 704 | |
История открытий и производства
Этиленгликоль впервые был получен в 1859 году французским химиком Вюрцем из диацетата этиленгликоля омылением гидроксидом калия и в 1860-м гидратацией этиленоксида. Он не находил широкого применения до Первой мировой войны, когда в Германии его стали получать из дихлорэтана для использования в качестве замены глицерина при производстве взрывчатых веществ.
В США полупромышленное производство начато в 1917 году через этиленхлоргидрин. Первое крупномасштабное производство начато с возведением завода в 1925 году около Саут Чарлстона (Западная Вирджиния, США) компанией «Carbide and Carbon Chemicals Co.» (англ.). К 1929 году этиленгликоль использовался практически всеми производителями динамита.
В 1937 компания Carbide начала первое крупномасштабное производство, основанное на газофазном окислении этилена до этиленоксида. Монополия компании Carbide на данный процесс продолжалась до 1953 года.
Получение
В промышленности этиленгликоль получают путём гидратации оксида этилена при 10 атм и 190‒200 °С или при 1 атм и 50‒100 °С в присутствии 0,1‒0,5 % серной или ортофосфорной кислоты, достигая 90 % выхода. Побочными продуктами при этом являются диэтиленгликоль, триэтиленгликоль и незначительное количество высших полимергомологов этиленгликоля.
Применение
Благодаря низкой стоимости этиленгликоль нашёл широкое применение в технике.
- Как компонент автомобильных антифризов и тормозных жидкостей, что составляет 60 % его потребления. Смесь 60 % этиленгликоля и 40 % воды замерзает при −49 °С. Применяется с ингибиторами коррозии;
- Используется как теплоноситель с содержанием не более 50 % в системах отопления (в основном в частных домах)
- В качестве теплоносителя в виде раствора в автомобилях, в системах жидкостного охлаждения компьютеров;
- В производстве целлофана, полиуретанов и ряда других полимеров. Это второе основное применение;
- Как растворитель красящих веществ;
- В органическом синтезе:
- в качестве высокотемпературного растворителя.
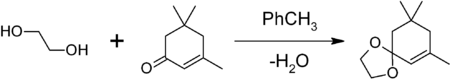
- для защиты карбонильной группы путём получения 1,3-диоксолана. Обработкой вещества с карбонильной группой в бензоле или толуоле этиленгликолем в присутствии кислого катализатора (толуолсульфоновой кислоты, BF3•Et2O и др.) и азеотропной отгонкой на насадке Дина-Старка образующейся воды. Например, защита карбонильной группы изофорона
1,3-диоксоланы могут быть получены также при реакции этиленгликоля с карбонильными соединениями в присутствии триметилхлорсилана[8] или комплекса диметилсульфат-ДМФА[9] 1,3-диоксалана устойчивы к действию нуклеофилов и оснований. Легко регенерируют исходное карбонильное соединение в присутствии кислоты и воды.
- Как компонент противоводокристаллизационной жидкости «И».
- Для поглощения воды, для предотвращения образования гидрата метана (ингибитор гидратообразования), который забивает трубопроводы при добыче газа в открытом море. На наземных станциях его регенерируют путём осушения и удаления солей.
- Этиленгликоль является исходным сырьём для производства взрывчатого вещества нитрогликоля.
Этиленгликоль также применяется:
- при производстве конденсаторов
- при производстве 1,4-диоксана
- как теплоноситель в системах чиллер-фанкойл
- в качестве компонента крема для обуви (1‒2 %)
- в составе для мытья стёкол вместе с изопропиловым спиртом
- при криоконсервировании биологических объектов (в крионике) в качестве криопротектора.
- при производстве полиэтилентерефталата, пластика популярных ПЭТ-бутылок.
Очистка и осушение
Осушается молекулярным ситом 4А, полуводным сульфатом кальция, сульфатом натрия, Mg+I2, фракционной перегонкой под пониженным давлением, азеотропной отгонкой с бензолом. Чистота полученного продукта легко определяется по плотности.
Таблица плотности водных растворов этиленгликоля, 20°С
| Концентрация % | 30 | 35 | 40 | 45 | 50 | 55 | 60 |
|---|---|---|---|---|---|---|---|
| Плотность, г/мл | 1,050 | 1,058 | 1,067 | 1,074 | 1,082 | 1,090 | 1,098 |
Меры безопасности
Этиленгликоль — горючее вещество. Температура вспышки паров 120 °C. Температура самовоспламенения 380 °C. Температурные пределы воспламенения паров в воздухе, °С: нижний — 112, верхний — 124. Пределы воспламенения паров в воздухе от нижнего до верхнего, 3,8‒6,4 % (по объёму).
Этиленгликоль умеренно токсичен[10][11]. По степени воздействия на организм относится к веществам 3-го класса опасности.
Летальная доза при однократном пероральном употреблении составляет 100‒300 мл этиленгликоля (1,5‒5 мл/кг массы тела)[12]. Имеет относительно низкую летучесть при нормальной температуре, пары́ обладают не столь высокой токсичностью и представляют опасность лишь при хроническом вдыхании, однако при этом об опасности сигнализируют раздражение и кашель. Противоядием при отравлении этиленгликолем являются этанол и 4-метилпиразол[13].
В организме метаболизируется путём окисления до альдегида гликолевой кислоты и далее до гликолевой кислоты, которая затем распадается до муравьиной кислоты и диоксида углерода. Также он частично окисляется до щавелевой кислоты, соли которой вызывают повреждения почечной ткани и мочеточников. Этиленгликоль и его метаболиты выводятся из организма с мочой[14].
Примечания
Ссылки
- ГОСТ 19710-83. Этиленгликоль. Технические условия. Архивная копия от 20 ноября 2018 на Wayback Machine (рус.)
- Об отравлениях этиленгликолем Архивная копия от 5 марта 2016 на Wayback Machine
- Hairong Yue, Yujun Zhao, Xinbin Ma and Jinlong Gong. Ethylene glycol: properties, synthesis, and applications. Critical Review Архивная копия от 21 ноября 2018 на Wayback Machine — Chemical Society Reviews. Issue 11, 2012, 41, 4218-4244. DOI: 10.1039/C2CS15359A