Гидрокарбонаты
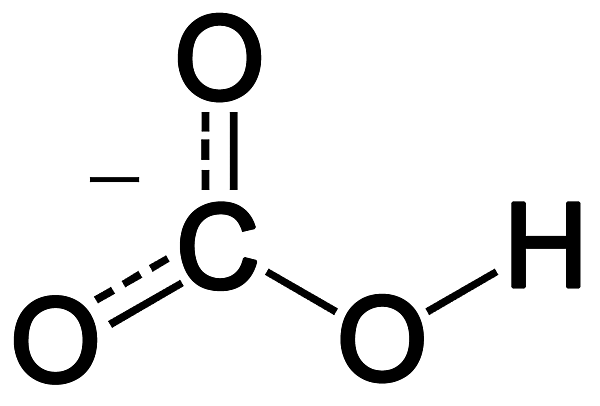
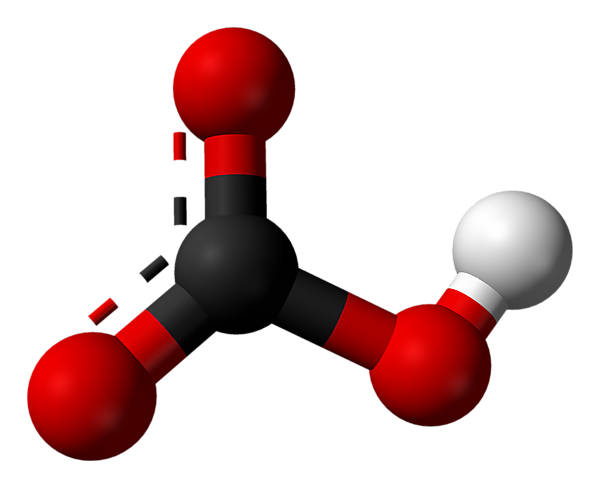
Гидрокарбона́ты — кислые соли угольной кислоты H2CO3. Формула аниона: HCO−
3. Устаревшие названия гидрокарбонатов: кислый, углекислый, двууглекислый, бикарбонаты.
Гидрокарбонаты практически всех элементов хорошо растворимы в воде, в том числе гидрокарбонаты щёлочноземельных металлов, в отличие от небольшого числа растворимых в воде карбонатов.
Что важно знать
| Гидрокарбонат-ион | |
|---|---|
| Общие | |
| Традиционные названия | Бикарбонат-ион |
| Хим. формула | HCO3- |
| Химические свойства | |
| Константа диссоциации кислоты | 10,4 |
| Классификация | |
| Рег. номер CAS | 71-52-3 |
| 3D model (JSmol) | Интерактивная схема |
| PubChem | 769 |
| UNII | HN1ZRA3Q20 |
| CompTox Dashboard EPA | DTXSID2049921 |
| SMILES | |
| InChI | |
| ChEBI | 17544 |
| ChemSpider | 749 |
Получение
В общем случае гидрокарбонаты образуются при длительном пропускании углекислого газа через водный раствор (или суспензию), содержащий карбонат:
, где Me — бивалентный катион металла.
Наиболее востребованный в промышленности и быту гидрокарбонат натрия получают по так называемому аммиачно-хлоридному способу. Гидрокарбонат натрия гораздо хуже растворим в ледяной воде, поэтому его можно отделить от хорошо растворимого хлорида аммония отделением осадка с помощью фильтрования:
Химические свойства
При нагревании гидрокарбонаты разлагаются на соответствующий карбонат, воду и углекислый газ:
Гидролиз гидрокарбонат-иона происходит по схеме:
Из-за этого водные растворы гидрокарбонатов всегда имеют слабощелочную или щелочную реакцию.
Взаимодействие со щелочами:
С кислотами:
Далее углекислый газ взаимодействует с водой с образованием угольной кислоты. Происходит это до тех пор, пока его концентрация не начнёт превышать равновесную для системы «угольная кислота/вода и углекислый газ», после чего начнут образовываться пузырьки газа.
Применение
Гидрокарбонат натрия (сода) используется в производстве искусственных минеральных вод, как действующий компонент огнетушителей. Также применяется в кондитерском деле, хлебопечении, в быту, в медицине, а также в качестве универсального «мягкого» нейтрализатора кислот.
Гидрокарбонат аммония используется в пищевой промышленности в качестве разрыхлителя для плоских хлебобулочных изделий, таких как печенье и крекеры.
Физиологическое действие
В организме гидрокарбонат-ион является неотъемлемой частью гидрокарбонатной буферной системы, регулирующей постоянство pH крови[1]. 70–75 % СО2 в организме превращается в угольную кислоту (Н2СО3), которая является сопряжённой кислотой по отношению к гидрокарбонат-иону и может быстро превратиться в него.
С угольной кислотой бикарбонат в сочетании с водой, ионами гидроксония и углекислым газом образует буферную систему, которая поддерживается в равновесии, необходимом для обеспечения устойчивости к изменениям pH. Это особенно важно для защиты тканей центральной нервной системы, где изменения pH, выходящие за пределы нормального диапазона в любом направлении, могут оказаться катастрофическими (см. ацидоз и алкалоз).
Кроме того, бикарбонат играет ключевую роль в пищеварительной системе. Он повышает pH содержимого двенадцатиперстной кишки после того, как очень кислый желудочный сок закончил переваривать пищу в желудке.
Гидрокарбонат-ион в окружающей среде
Гидрокарбонат-ион является преобладающей формой растворённого неорганического углерода в морской воде и в большинстве пресных вод. Он является важным поглотителем углерода в углеродном цикле.
В экологии пресных вод сильная фотосинтетическая активность пресноводных растений при дневном свете способствует выделению в воду газообразного кислорода и гидрокарбонат-ионов. Далее они сдвигают pH в щелочную сторону до тех пор, пока при определенных обстоятельствах уровень щелочности не станет токсичным для некоторых организмов или не сделает токсичными другие химические компоненты (например, аммиак). В темноте, когда фотосинтез практически не происходит, в результате процессов дыхания выделяется углекислый газ, и новые ионы бикарбоната не образуются, что приводит к быстрому падению рН.
Выщелачивание некоторых горных пород происходит благодаря превращению их в гидрокарбонаты из карбонатов под действием дождевой воды с растворённым в ней углекислым газом. В то же время данный процесс обратим и является частью цикла круговорота углерода в природе.
Примечания
Литература
- Кнунянц И. Л. и др. т. 3 Мед-Пол // Химическая энциклопедия. — М.: Большая Российская Энциклопедия, 1992. — 639 с. — 50 000 экз. — ISBN 5-85270-039-8.
- Ф. Н. Капуцкий, В. Ф. Тикавый. Пособие по химии для поступающих в вузы. — Минск: Выш. школа, 1979. — С. 384.
- Г. П. Хомченко. Химия для поступающих в вузы. — М.: Высшая школа, 1994. — С. 447.





![{\displaystyle {\ce {NaCl + NH3 + CO2 + H2O ->[{0 °C}] NaHCO3v + NH4Cl}}}](https://ru.ruwiki.ru/api/rest_v1/media/math/render/svg/44d8574c56c40f8d14b5d63da1b3e87579dfacf3)
![{\displaystyle {\ce {2NaHCO3->[t] Na2CO3 + CO2 + H2O}}}](https://ru.ruwiki.ru/api/rest_v1/media/math/render/svg/6e11ce2fa740bc5971f19b0124be72575e2e0b5d)



