Аллотропия углерода
Углерод — вещество с самым[1] большим числом аллотропических модификаций (более 9 обнаруженных на данный момент).
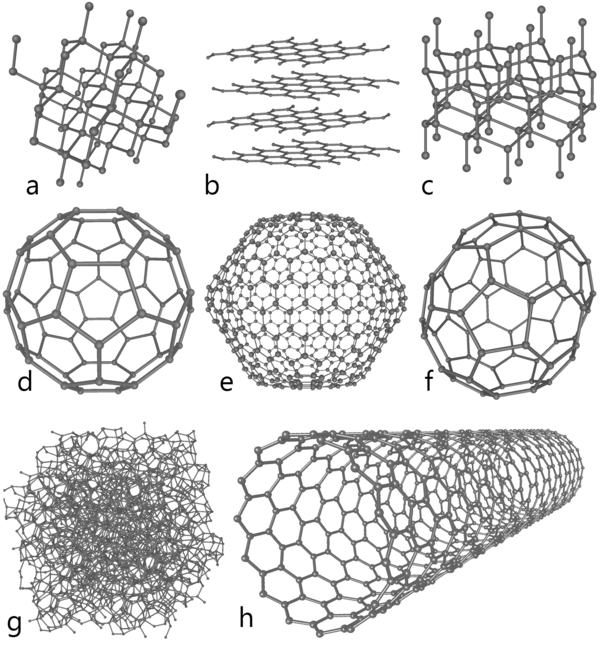
Аллотропные модификации углерода по своим свойствам наиболее радикально отличаются друг от друга, от мягкого к твёрдому, непрозрачного к прозрачному, абразивного к смазочному, недорогого к дорогому. Эти аллотропы включают аморфные аллотропы углерода (уголь, сажа), нанопена, кристаллические аллотропы — нанотрубка, алмаз, фуллерены, графит, лонсдейлит.
Классификация
Классификация аллотропов углерода по характеру химической связи между атомами:
- sp3 формы:
- Алмаз (куб)
- Лонсдейлит (гексагональный алмаз)
- sp2 формы
- sp формы:
- Смешанные sp3/sp2 формы:
- Смешанные sp2/sp формы:
- Другие формы: C1 — C2 — C3 — C8
Алмаз
Алмаз является одним из наиболее известных аллотропов углерода, чья твёрдость и высокая степень рассеивания света делает его полезным в промышленном применении и в ювелирных изделиях. Алмаз — самый твёрдый известный природный минерал, что делает его отличным абразивом и позволяет использовать для шлифовки и полировки. В природной среде нет ни одного известного вещества, способного поцарапать даже мельчайший фрагмент алмаза.
Рынок алмазов промышленного класса несколько отличен от рынков других драгоценных камней. Используемые в промышленности алмазы ценятся главным образом за их твёрдость и теплопроводность, из-за чего другие геммологические характеристики алмазов, в том числе чистота и цвет, по большей части излишни. Это помогает объяснить, почему 80 % добываемых алмазов (что эквивалентно примерно 100 млн. каратам или 20000 кг в год), непригодно для использования в качестве драгоценных камней и известны как борт, предназначенные для промышленного использования. В дополнение к добываемым алмазам, находят промышленное применение и искусственные синтетические алмазы, используемые практически сразу же после их изобретения в 1950 г., а ещё 400 миллионов каратов (80000 кг) синтетических алмазов выпускаются ежегодно для промышленного использования — почти в четыре раза больше массы природных алмазов, добытых за тот же период.
Основным промышленным применением алмазов является резка, сверление (в наконечниках свёрл и буров), шлифовка (резка алмазными гранями) и полировка. Большинство используемых в этих технологиях алмазов не требует крупных образцов; фактически, большинство алмазов качества драгоценных камней, могут использоваться в промышленности. Алмазы вставляются в наконечники буров или режущие кромки пилы или измельчаются в порошок для использования в процессах шлифования и полирования. Специализированное применение включает в себя использование в лабораториях в качестве сдерживающих веществ при экспериментах с высоким давлением, в высокопроизводительных подшипниках и ограниченное применение в специализированных окнах.
С продолжающимся увеличением в производстве синтетических алмазов, их будущее применение становится более осуществимым. Накопление большого запаса — это возможность использовать алмазы в качестве полупроводников при изготовлении микрочипов или использовать для поглощения тепла в электронике. Значительные достижения в исследованиях в Японии, Европе и Соединённых Штатах позволяют использовать возможности, предоставляемые уникальными свойствами алмазного вещества, в сочетании с повышением качества и количества, обеспечиваемыми производителями синтетических алмазов.
Каждый атом углерода в алмазе ковалентен с четырьмя другими атомами углерода в тетраэдре. Эти тетраэдры вместе образуют трёхмерную сеть из слоёв шестичленных колец атомов. Эта устойчивая сеть ковалентных связей и трёхмерное распределение связей является причиной такой твёрдости алмазов.
В ноябре 2017 года ученые SLAC и DESY превратили алмаз в графит посредством мягкого облучения фемтосекундным лазером.
Графит
Графит (назван Абрахамом Готтлобом Вернером в 1789 г, (с греческого графен — «тянуть/писать», использовался в карандашах) — один из самых обычных аллотропов углерода. Характеризуется гексагональной слоистой структурой. Встречается в природе. Твердость по шкале Мооса 1. Его плотность — 2.3, она меньше чем у алмаза. Приблизительно при 700 °C горит в кислороде, образовывая углекислый газ. По химической активности более реакционен чем алмаз. Это связано с проникновением реагентов между гексагональными слоями атомов углерода в графите. Не взаимодействует с обычными растворителями, кислотами или расплавленными щелочами. Однако, хромовая кислота окисляет его до углекислого газа. Получают нагреванием смеси пека и кокса при 2800 °C; из газообразных углеводородов при 1400—1500 °C при пониженных давлениях с последующим нагреванием образовавшегося пироуглерода при 2500−3000 °C и давлении около 50 МПа с образованием пирографита. В отличие от алмаза, графит обладает электропроводностью и широко применяется в электротехнике. Графит является самой устойчивой формой углерода при стандартных условиях. Поэтому в термохимии он принят за стандартное состояние углерода. Применяется для изготовления плавильных тиглей, футеровочных плит, электродов, нагревательных элементов, твердых смазочных материалов, наполнителя пластмасс, замедлителя нейтронов в ядерных реакторах, стержней карандашей, при высоких температурах и давлениях (более 2000 °C и 5 ГПа) для получения синтетического алмаза.
Порошок графита используется как сухая смазка. Однако в вакууме он заметно теряет смазочные свойства, это связано с тем, что смазочные свойства графита связаны с адсорбрцией воздуха и воды между слоями в графите, в отличие от других слоистых сухих смазок, типа дисульфида молибдена. При большом количестве кристаллографических дефектов, которые связывают слои в структуре, графита, он также теряет смазывающие свойства и становится подобным пиролитическому графиту.
Природные и кристаллические графиты редко используются в чистой форме из-за их скалываемости, хрупкости и противоречивых механических свойств.
Его чистые структурно изотропные синтетические формы, как например пиролитический графит и углеродистые графитовые волокна, представляют чрезвычайно прочный, огнеупорный (до 3000 °C) материал, используемый для защиты носовых конусов ракет, в конструкциях сопел твердотопливных двигателей ракеты, высокотемпературных реакторов, тормозных колодок и электрических моторных щеток.
Вспучивающиеся или растяжимые графиты используются в печах нагрева для герметизации её элементов. В процессе нагрева графит вспучивается (расширяется и обжигается) и герметизирует области контакта. Типичная температура начала расширения (область температур) — между 150 и 300 °C. Электропроводность графита связана с делокализацией электронов пи — связей выше и ниже плоскостей расположения атомов углерода. В отличие от алмаза, в котором все четыре внешних электрона каждого атома углерода 'локализованы' между атомами в ковалентной связи, в графите, каждый атом связан ковалентной связью только с 3 из его 4 внешних электронов. Поэтому каждый атом углерода вносит один электрон в делокализованную систему электронов. Эти электроны находятся в зоне проводимости. Однако электропроводность графита ориентирована по поверхности слоев. Поэтому графит проводит электричество по плоскости слоя атомов углерода, но не проводит в направлении под прямым углом к плоскости.
Другие возможные формы
- Чароит — минерал, который, как считают, сформирован под воздействием ударов метеоритов. Он описывается как несколько более твёрдый, чем графит, с отблеском от серого до белого цвета. Тем не менее, существование такого состояния углерода считается спорным.
- Металлический углерод — теоретические исследования показали, что в фазовой диаграмме углерода в области очень высоких давлений есть области, где он металлический [2] Также показано, что в этих условиях углерод может стать сверхпроводящим при очень низкой температуре (4К) [3].
- Диуглерод — метастабильные частицы С2
- M-углерод — моноклинная сверхтвёрдая форма углерода[4][5]
- C8 — кристаллическая фаза С8со структурой углеродного содалита [6].
- Карбин - атомы углерода образуют некие "нити".
См. также
Примечания
Ссылки
- Загадочные аллотропы углерода (англ.) (Дата обращения: 30 июня 2008)
- Углерод и его структуры (англ.) (Дата обращения: 30 июня 2008)