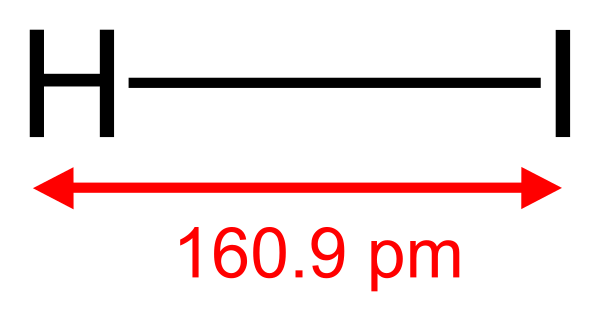
Иодоводород
Иóдоводорóд (гидроиодид, иóдистый водорóд, HI) — бесцветный удушливый газ (при нормальных условиях), сильно дымит на воздухе. Хорошо растворим в воде, образует азеотропную смесь с Ткип 127 °C и концентрацией HI 57 %. Неустойчив, разлагается при 300 °C.
Что важно знать
| Иодоводород | |
|---|---|
| Общие | |
| Систематическое наименование |
Иодоводород |
| Традиционные названия | Гидроиодид, иодистый водород |
| Хим. формула | HI |
| Рац. формула | HI |
| Физические свойства | |
| Состояние | бесцветный газ |
| Молярная масса | 127.904 г/моль |
| Плотность | 2.85 г/мл (-47 °C) |
| Термические свойства | |
| Температура | |
| • плавления | –50.80 °C |
| • кипения | –35.36 °C |
| • разложения | 300 °C |
| Критическая точка | 150,7 °C |
| Энтальпия | |
| • образования | 26,6 кДж/моль |
| Химические свойства | |
| Константа диссоциации кислоты | - 11 |
| Растворимость | |
| • в воде | 72,47 (20°C) |
| Классификация | |
| Рег. номер CAS | [10034-85-2] |
| 3D model (JSmol) | Интерактивная схема |
| PubChem | 24841 |
| UNII | 694C0EFT9Q |
| CompTox Dashboard EPA | DTXSID2044349 |
| Рег. номер EINECS | 233-109-9 |
| SMILES | |
| InChI | |
| RTECS | MW3760000 |
| ChEBI | 43451 |
| ChemSpider | 23224 |
| ECHA InfoCard | 100.030.087 |
| Безопасность | |
| NFPA 704 | |
Получение
В промышленности HI получают по реакции иода с гидразином:
В лаборатории HI можно получать с помощью окислительно-восстановительных реакций:
Восстанавливая иод другими восстановителями:
Воздействием стабильной и достаточно сильной кислоты на иодиды (обычно берут горячую концентрированную ортофосфорную кислоту, серная не подходит):
Очень часто ортофосфорную кислоту производят контактным методом, и поэтому она загрязнена и серной кислотой, что при получении иодоводорода является крайне опасным (выделяется чрезвычайно токсичный сероводород). Именно по этой причине, в лабораториях чаще прибегают к восстановлению иода.
и реакций обмена:
Реакцию следует проводить в водном растворе в отсутствие спиртов.
Иодоводород также получается при взаимодействии простых веществ. Эта реакция идет только при нагревании и протекает не до конца, так как в системе устанавливается равновесие:
На одной из стадии получения иодоводорода (получение иодидов из иода) следует убедиться в отсутствии спиртов в растворе, так как будет образовываться иодоформ, который при получении иодоводорода окисляет его до иода (восстанавливаясь до дииодметана).
Свойства
Водный раствор HI называется иодоводородной кислотой (бесцветная жидкость с резким запахом). Иодоводородная кислота является сильной кислотой (pKа = −11)[1]. Соли иодоводородной кислоты называются иодидами. В 100 г воды при нормальном давлении и 20 °C растворяется 132 г HI, а при 100 °C — 177 г. 45%-ная йодоводородная кислота имеет плотность 1,4765 г/см³.
Иодоводород является сильным восстановителем. На воздухе водный раствор HI окрашивается в бурый цвет вследствие постепенного окисления его кислородом воздуха и выделения молекулярного иода:
HI способен восстанавливать концентрированную серную кислоту до сероводорода:
Подобно другим галогенводородам, HI присоединяется к кратным связям (реакция электрофильного присоединения):
Иодиды присоединяют элементарный иод с образованием полииодидов:
Что обуславливает тёмно-бурый цвет долго стоящей на воздухе иодоводородной кислоты.
Под действием света щелочные соли разлагаются, выделяя I2, придающий им жёлтую окраску. Иодиды получают взаимодействием иода со щелочами в присутствии восстановителей, не образующих твердых побочных продуктов: муравьиная кислота, формальдегид, гидразин:
Можно использовать также сульфиты, но они загрязняют продукт сульфатами. Без добавок восстановителей при получении щелочных солей наряду с иодидом образуется иодат MIO₃ (1 часть на 5 частей иодида).
Ионы Cu2+ при взаимодействии c иодидами легко дают малорастворимый иодид одновалентной меди CuI:
Замещает элементы в кислородных кислотах по реакциям
Образующийся пентайодид фосфора гидролизуется водой.
Применение
Иодоводород используют в лабораториях как восстановитель во многих органических синтезах, а также для приготовления различных иодсодержащих соединений.
Спирты, галогениды и кислоты восстанавливаются HI, давая алканы[3].
При действии HI на пентозы он все их превращает во вторичный иодистый амил: CH3CH2CH2CHICH3, а гексозы — во вторичный иодистый н-гексил[4]. Легче всего восстанавливаются иодпроизводные, некоторые хлорпроизводные не восстанавливаются вовсе. Третичные спирты восстанавливаются легче всего. Многоатомные спирты также реагируют в мягких условиях, часто давая вторичные иодалкилы[5].
HI при нагреве диссоциирует на водород и I2, что позволяет получать водород с низкими энергетическими затратами.
Физиологическое воздействие и токсикология
- Иодоводород — едкое, токсичное вещество. Обладает удушающим действием.
- При попадании на кожу иодоводородная кислота может вызвать ожоги.
- Предельно допустимая концентрация иодоводорода в воздухе рабочей зоны составляет 2 мг/м³.
- Согласно ГОСТ 12.1.007-76 йодистоводородная кислота относится к III классу опасности (умеренно-опасное химическое вещество).
Литература
- Ахметов Н. С. Общая и неорганическая химия. — М.: Высшая школа, 2001.