Простые и сложные вещества
Материал ОГЭ/ЕГЭ
Простые и сложные вещества — это классы химических веществ, отличающиеся по составу и структуре. Простые вещества состоят из атомов одного химического элемента, а сложные — из атомов разных элементов, связанных между собой химическими связями.
Основные понятия
- Простое вещество — вещество, молекулы или кристаллы которого состоят из атомов одного химического элемента.
* Примеры: кислород , озон , водород , азот , алмаз (углерод).
- Сложное вещество — вещество, состоящее из атомов двух или более различных химических элементов, соединённых химическими связями.
* Примеры: вода , углекислый газ , хлорид натрия , метан .
Аллотропия
Аллотропия — существование нескольких простых веществ (аллотропных модификаций), образованных одним химическим элементом, но различающихся по строению и свойствам.
Примеры аллотропии:
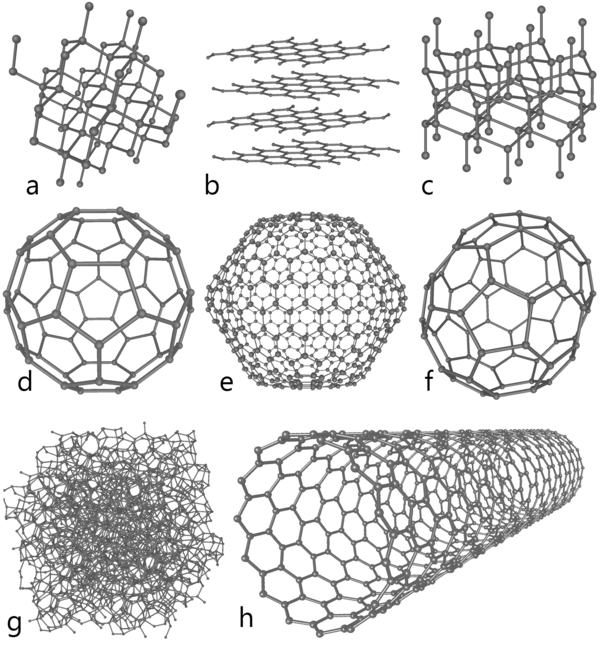
- Углерод:
* Алмаз — сверхтвёрдое вещество с тесно упакованной кристаллической решёткой. * Графит — мягкое вещество с слоистой структурой. * Фуллерены, нанотрубки — молекулярные формы углерода.
- Кислород:
* Кислород — бесцветный газ. * Озон — газ с резким запахом, более реакционноспособен.
Отличия между простыми и сложными веществами
- Состав:
* Простые вещества состоят из одного элемента. * Сложные вещества состоят из нескольких элементов.
- Строение:
* В простых веществах атомы связаны одинаковыми связями. * В сложных веществах присутствуют различные виды связей между разными элементами.
- Химические свойства:
* Простые вещества могут вступать в реакции с образованием как простых, так и сложных веществ. * Сложные вещества могут разлагаться на простые или реагировать с другими веществами.
Агрегатные состояния простых веществ
При нормальных условиях простые вещества могут находиться в различных агрегатных состояниях:
- Газообразные: водород , кислород , азот .
- Жидкие: бром , ртуть .
- Твёрдые: углерод (алмаз, графит), сера , фосфор (белый, красный).
Классы химических соединений
Сложные вещества разделяют на неорганические и органические соединения.
- Оксиды: соединения элементов с кислородом (например, , ).
- Кислоты: вещества, способные отдавать протоны (например, соляная кислота , серная кислота ).
- Основания: вещества, способные принимать протоны (например, гидроксид натрия ).
- Соли: продукты взаимодействия кислот и оснований (например, хлорид натрия ).
- Углеводороды: соединения углерода и водорода (например, метан , этан ).
- Спирты: содержат гидроксильную группу (например, этанол ).
- Карбоновые кислоты: содержат карбоксильную группу (например, уксусная кислота ).
Отношение понятий атом, химический элемент и простое вещество
- Атом — мельчайшая частица вещества, сохраняющая его химические свойства.
- Химический элемент — совокупность атомов с одинаковым зарядом ядра.
- Простое вещество — вещество, состоящее из атомов одного химического элемента.
Важно различать эти понятия:
- Атом — частица.
- Химический элемент — тип атомов.
- Простое вещество — вещество, состоящее из атомов одного элемента.
Применение простых и сложных веществ
- Простые вещества используют в качестве сырья в промышленности (кислород для дыхания, водород в качестве топлива).
- Сложные вещества широко применяются в быту и промышленности (вода для жизни, углекислый газ в пищевой промышленности, металлы в строительстве).
Заключение
Понимание различий между простыми и сложными веществами является основой химии. Простые вещества, состоящие из одного элемента, могут существовать в различных аллотропных формах, демонстрируя разнообразие свойств. Сложные вещества, образованные разными элементами, составляют огромное множество соединений, изучение которых важно для науки и промышленности.
Литература
- Габриелян О. С., Остроумов И. Г., Ахлебинин А. К. Химия. 7 класс.. — "Дрофа", 2019. — 161 с.
- Габриелян О. С., Остроумов И. Г., Сладков С.А. Химия. 8 класс. Базовый уровень.. — «Просвещение», 2024. — 176 с.
- Габриелян О. С. Химия. 8 класс.. — "Дрофа", 2019. — 284 с.
- Габриелян О. С., Остроумов И. Г., Сладков С.А. Химия. 9 класс.. — «Просвещение», 2023. — 224 с.
- Ерёмин В. В., Кузьменко Н. Е., Дроздов А. А. и др. Химия. 9 класс.. — 2022. — 291 с.